| 物竞编号 | 02HS |
|---|---|
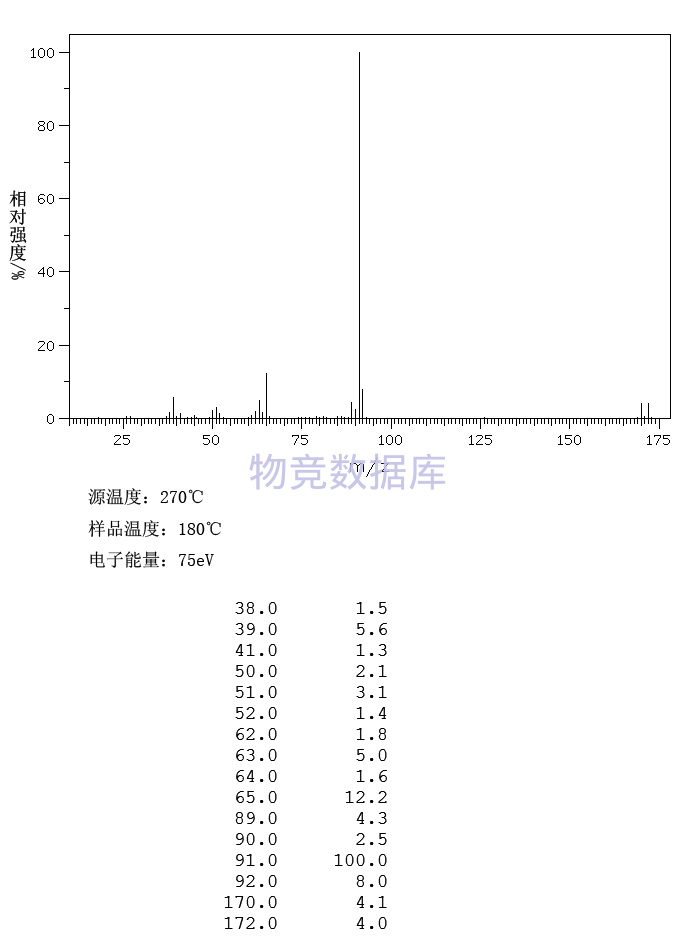
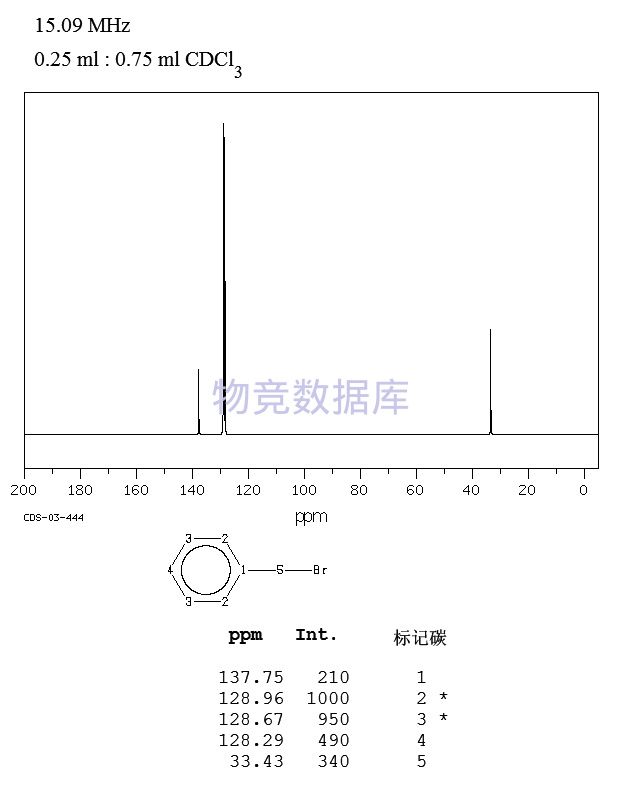
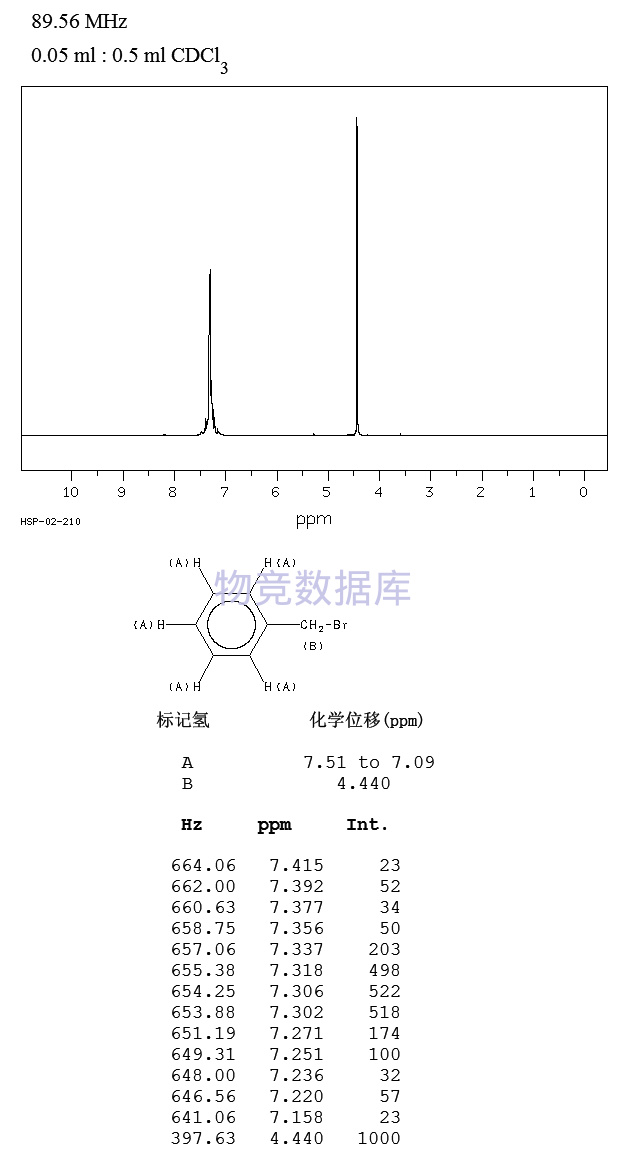
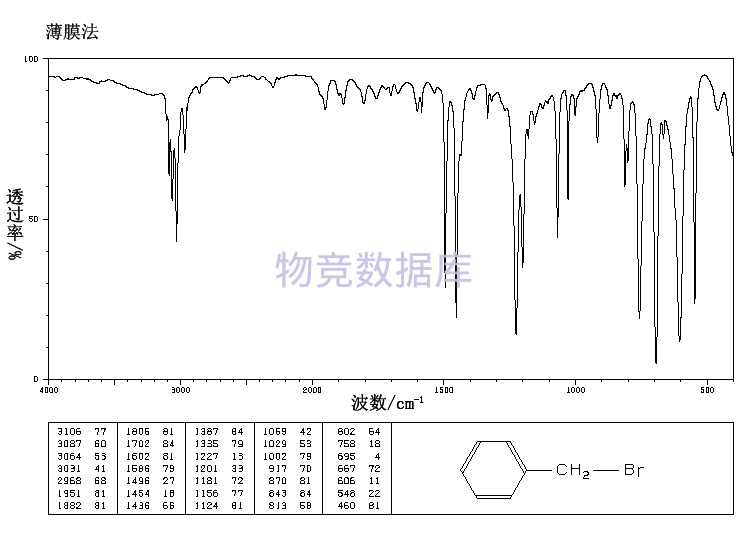
| 分子式 | C7H7Br |
| 分子量 | 171.03 |
| 标签 | α-溴甲苯, 溴苄, 溴甲苯, 溴甲基苯, 溴化苄, 苄基溴, 苯甲溴, 1-Bromotoluene, α-Bromo-toluene, Bromophenylmethane, 发泡剂, 卤代烃类溶剂 |
编号系统
CAS号:100-39-0
MDL号:MFCD00000172
EINECS号:202-847-3
RTECS号:XS7965000
BRN号:385801
PubChem号:24848056
物性数据
1.性状:无色液体,有芳香气味,具有催泪性。[10]
2.熔点(℃):-4.0[11]
3.沸点(℃):198[12]
4.相对密度(水=1):1.44[13]
5.相对蒸气密度(空气=1):5.8[14]
6.饱和蒸气压(kPa):0.133(32℃)[15]
7.燃烧热(kJ/mol):-4278.2[16]
8.辛醇/水分配系数:2.92[17]
9.闪点(℃):79(CC)[18]
10.溶解性:不溶于水,溶于乙醇、乙醚、苯。[19]
毒理学数据
1、 致突变性:突变微生物试验:细菌-鼠伤寒沙门氏菌,300μmol/L; 非定性DNA综合试验:细菌-大肠杆菌,1300μmol/L; 姐妹染色单体交换试验:仓鼠卵巢,30μmol/L;
2、对眼睛和黏膜有强刺激作用。对机体有不可逆损伤的可能性。
3.其他[20] LCLo:2000mg/m3(兔吸入,30min)
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性[21] 空气中,当羟基自由基浓度为5.00×105个/cm3时,降解半衰期为7.1d(理论)。在25℃时,水解半衰期为79min(理论)。
4.生物富集性[22] BCF:35(理论)
分子结构数据
1、摩尔折射率:38.90
2、摩尔体积(cm3/mol):118.9
3、等张比容(90.2K):296.2
4、表面张力(dyne/cm):38.4
5、介电常数:
6、偶极距(10-24cm3):
7、极化率:15.42
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:1
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:8
8.表面电荷:0
9.复杂度:55.4
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.化学性质活泼,溴原子易被羟基、氨基等取代生成苄醇、苄胺等。
2.稳定性[23] 稳定
3.禁配物[24] 碱类、胺类、强氧化剂、醇类
4.避免接触的条件[25] 受热
5.聚合危害[26] 不聚合
6.分解产物[27] 溴化氢
贮存方法
储存注意事项[28] 储存于阴凉、通风的库房。远离火种、热源。保持容器密封。应与氧化剂、碱类、胺类、醇类、食用化学品分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
由甲苯溴化而得。将甲苯加热到50℃,加溴反应,反应温度为75-80℃,反应6h,在常压下分馏除去140℃以前的馏分,然后减压蒸馏,收集112-114℃(2.0kPa)馏分,得苄基溴。
用途
1.苄溴的最大用途是作为杂原子官能团的苄基化试剂,在各种条件下能有效地对各种杂原子官能团发生苄基化,从而在有机合成中具有广泛的用途 (主要是作为保护基团使用)[1]。
醇和酚能与苄溴在碱性条件下发生反应。如在醚类或DMF溶剂中,将醇用NaH或KH处理得到烷氧化合物,进而与苄溴发生Williamson反应[2]。在低温下,一级醇相比二级醇能更优先发生苄基化反应。除了NaH和KH碱性体系外,使用KF/Al或Ag2O同样可以作为碱体系诱导醇的苄基化反应。
苄基化反应在糖类化合物中的应用非常成功。首先将糖类衍生物用锡试剂预处理,然后发生苄基化反应,这样可以在轴向羟基存在下选择性地实现平伏羟基的保护 (式1)[3]。
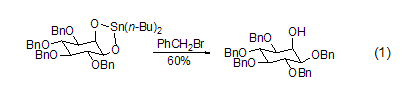
对于空间位阻较大的醇化合物的苄基化反应,可以采取加入催化剂量的碘试剂如(n-Bu)4NI作为碘源,将苄溴转变为活性更高的苄碘,从而更容易实现苄基化反应。由于酚类化合物相比脂肪醇化合物具有更强的酸性,因此,酚的苄基化反应只需要弱碱如碳酸钾即可实现[4]。
苄溴也可以保护胺类化合物的含氮基团。反应也需要在碱性条件下完成,并且对于一级胺的反应主要产物是双苄基化产物[5]。此外,酰胺、内酰胺、磺酰胺以及含氮杂环均能与苄溴反应。
含硫化合物如硫醇、硅基硫醚等也能在碱性条件下与苄溴发生反应,如L-半胱氨酸与苄溴在氢氧化钠碱液中的反应 (式2)。在DMF溶剂或羰基锌的作用下,苄溴也能与羧酸阴离子反应制备苄基羧酸酯化合物[6]。
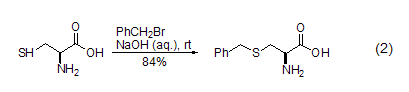
苄溴还能与带活泼亚甲基的化合物如烯醇式酮、酯、1,3-二羰基化合物、酰胺、内酰胺以及硝基稳定的碳阴离子发生烷基化反应。如苄溴与金属烯胺在手性亚胺作用下发生的苄基化反应能够获得较好的对映选择性 (式3)[7]。

苄溴与活泼金属反应制备苄基金属化合物(如苄基锂)很难实现,主要原因是生成的化合物能容易发生Wurz偶联反应[8]。但也有例外,如苄基溴化镁、苄基溴化锌以及BnCu(CN)ZnBr均是成功的例子。
苄溴倾向于与有机金属化合物如烷基锂、格氏试剂、烷基酮等发生偶联反应。如苄溴与N-甲基邻苯二甲酰亚胺在Li的作用下发生的偶联反应 (式4)[9]。
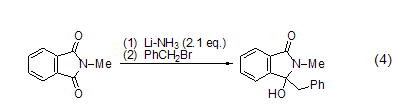
2.用于有机合成及制造发泡剂。[29]
安全信息
危险运输编码:UN 1737 6.1/PG 2
危险品标志: 刺激
刺激
安全标识:S39
危险标识:R36/37/38
文献
1. (a) Greene, T. W.; Wuts, P. G. M. Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991. (b) Protective Groups in Organic Chemistry, McOMie, J. F. W., Ed.; Plenum: New York, 1973. 2. Nicolaou, K. C.; Pavia, M. R.; Seitz, S. P. J. Am. Chem. Soc., 1981, 103, 1224. 3. (a) Nashed, M. A.; Anderson, L. Tetrahedron Lett., 1976, 3503. (b) Cruzado, C.; Bernabe, M.; Martin-Lomas, M. J. Org. Chem., 1989, 54, 465. 4. Schmidhammer, H.; Brossi, A. J. Org. Chem., 1971, 36, 746. 5. Yamazaki, N.; Kibayashi, C. J. Am. Chem. Soc., 1989, 111, 1396. 6. Shono, T.; Ishige, O.; Uyama, H.; Kashimura, S. J. Org. Chem., 1986, 51, 546. 7. Saigo, K.; Kashahara, A.; Ogawa, S.; Nohira, H. Tetrahedron Lett., 1983, 24, 511. 8. Wakefield, B. J. Organolithium Methods, Academic: New York, 1988. 9. Flynn, G. A. Chem. Commun. 1980, 862. [1~9]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [10~29]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无



 沪公网安备 31010602001115号
沪公网安备 31010602001115号