| 物竞编号 | 01CG |
|---|---|
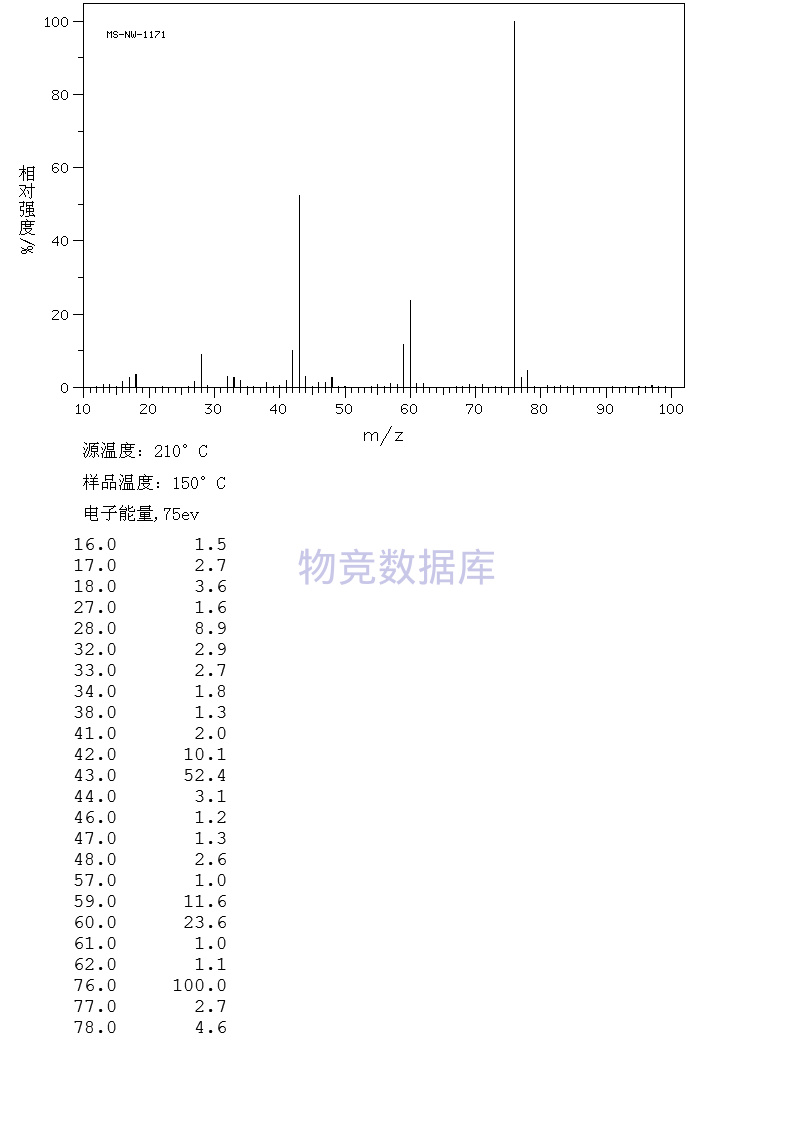
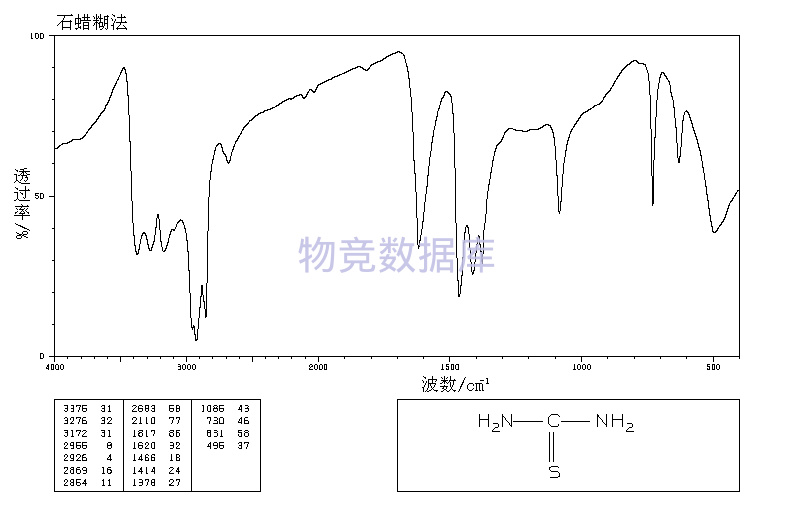
| 分子式 | CH4N2S |
| 分子量 | 76 |
| 标签 | 硫代尿素, 硫尿素, 硫代碳酰二胺, Thiocarbamide, Sulfourea, 脂肪族含硫化合物, 有机缓蚀材料 |
编号系统
CAS号:62-56-6
MDL号:MFCD00008067
EINECS号:200-543-5
RTECS号:YU2800000
BRN号:605327
PubChem号:24889147
物性数据
1.性状:白色光亮苦味晶体[1]
2.熔点(℃):182[2]
3.沸点(分解,℃):263[3]
4.相对密度(水=1):1.41[4]
5.临界压力(MPa):8.23[5]
6.辛醇/水分配系数:-1.08~-1.02[6]
7.闪点(℃):>182[7]
8.溶解性:溶于冷水、乙醇,微溶于乙醚。[8]
毒理学数据
1.急性毒性[9] LD50:125mg/kg(大鼠经口);100mg/kg(小鼠腹腔)
2.刺激性[10] 兔经眼:14%,引起刺激。
3.致突变性[11] 微生物致突变:鼠伤寒沙门菌150μg/皿;酿酒酵母菌52600μmol/L。
4.致畸性[12] 大鼠孕后12d经口给予最低中毒剂量(TDLo)240mg/kg,致中枢神经系统、肌肉骨骼系统发育畸形。大鼠孕后16~22d经口给予最低中毒剂量(TDLo)1400mg/kg,致内分泌系统发育畸形。
5.致癌性[13] IARC致癌性评论:G3,对人及动物致癌性证据不足。
6.其他[14] 大鼠经口最低中毒剂量(TDLo):40mg/kg(孕后用药1d),对胎鼠中枢神经系统、肌肉、骨骼系统有影响。
生态学数据
1.生态毒性[15] LC50:>100mg/L(96h)(黑头呆鱼);1.8mg/L(48h)(水蚤)
2.生物降解性[16] MITI-I测试,初始浓度100ppm,污泥浓度30ppm,2周后降解2.6%。
3.非生物降解性[17] 空气中,当羟基自由基浓度为5.00×105个/cm3时,降解半衰期为0.4d(理论)。
4.其他有害作用[18] 该物质对环境有危害,由于热分解而形成的硫化物和氮氧化物,对大气会造成污染。
分子结构数据
1、摩尔折射率:21.04
2、摩尔体积(cm3/mol):57.3
3、等张比容(90.2K):176.5
4、表面张力(dyne/cm):89.5
5、极化率(10-24cm3):8.34
计算化学数据
1.疏水参数计算参考值(XlogP):-0.8
2.氢键供体数量:2
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:2
6.拓扑分子极性表面积84.1
7.重原子数量:4
8.表面电荷:0
9.复杂度:29
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.在空气中易潮解。在150℃时转变成硫氰酸铵。在真空下150-160℃时升华,180℃时分解。具有还原性,能使游离态碘还原成碘离子。本品富于反应性,用以制备各种化合物。能与多种氧化剂反应生成脲、硫酸及其他有机化合物,也能与无机化合物制成易溶解的加成化合物。
2.本品一次作用时毒性小,反复作用时能经皮肤吸收,抑制甲状腺和造血器官的机能,引起中枢神经麻痹及呼吸和心脏功能降低等症状。生产本品1~15年的工人,会出现头痛、嗜眠、全身无力、皮肤干燥、口臭、口苦、腹上部疼痛、便秘、尿频等症状。典型症状为面色苍白、面部虚肿、腹胀、基础代谢降低,血压降低,脉搏变慢,心电图有变化。还会出现皮肤病等症状。本品对蛙的LD50为10G/KG,对鼠皮下注射的D50为4g/kg。对人的致死量,文献记载为10g/kg。生产本品的工人应戴防毒口罩,穿防护服,注意安全。生产设备应密闭,无跑、冒、滴、漏现象。
3.稳定性[19] 稳定
4.禁配物[20] 强氧化剂、强酸
5.避免接触的条件[21] 受热
6.聚合危害[22] 不聚合
7.分解产物[23] 硫化物
贮存方法
储存注意事项[24] 储存于阴凉、通风的库房。远离火种、热源。包装密封。应与氧化剂、酸类、食用化学品分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有合适的材料收容泄漏物。
合成方法
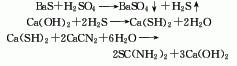
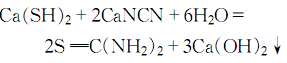
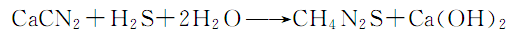
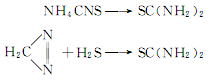
用途
1.本品用以合成磺胺噻唑、蛋氨酸和肥猪片等药物的原料。用作染料及染色助剂、树脂及压塑粉的原料。也可用作橡胶的硫化促进剂、金属矿物的浮选剂、制邻苯二甲酸酐和富马酸的催化剂,以及用作金属防锈蚀剂。在照相材料方面,可作为显影剂和调色剂。还可用于电镀工业。硫脲还用于重氮感光纸、合成树脂涂料、阴离子交换树脂、发芽促进剂、杀菌剂等许多方面。硫脲也作为化肥使用。医药上用作生产药物的中间体。橡胶工业上用作硫化促进剂。采矿业上用作浮选剂。还用作织物、纸张处理剂,印染助剂。
2.分析试剂。用于铋、锇、铑、硒、铅、碲、亚硝酸盐等的测定。测定锇的络合指示剂。
3.用于制备环氧树脂快速固化剂。也可用作三聚氰胺甲醛树脂胶黏剂的增韧剂。医药工业中用于制造磺胺噻唑、蛋氨酸、吡哌酸及抗甲状腺药等。有机合成中用于制造甲基硫脲、二乙基硫脲、二苯基硫脲、二氧化硫脲等硫脲衍生物。农药工业用于制造杀虫剂。也用作偶氮感光纸还原剂、金属防锈剂、尼龙及聚酯纤维的加工助剂、橡胶硫化促进剂、矿物浮选剂、有机合成催化剂、电镀添加剂等。
4.用于氢氟酸酸洗缓蚀剂,用于酸洗除铜剂。
5.在氨三乙酸镀锌中,硫脲可用作光亮剂,同时还能提高阴极极化作用,使镀层光泽,结晶细致,提高溶液的均镀能力。
6.用于有机合成,也用作药品、橡胶促进剂、镀金材料等。[25]
安全信息
危险运输编码:UN 2811 6.1/PG 3
危险品标志: 有害
有害  危害环境
危害环境
文献
[1~25]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号