| 物竞编号 | 0JZU |
|---|---|
| 分子式 | NiCl2 |
| 分子量 | 129.60 |
| 标签 | 氯化镍, 氯化亚镍, 无水氯化镍, 無水氯化鎳, 超干氯化镍(II), 无水氯化镍(II), 吸收剂 |
编号系统
CAS号:7718-54-9
MDL号:MFCD00011137
EINECS号:231-743-0
RTECS号:QR6475000
BRN号:暂无
PubChem号:24845332
物性数据
1. 性状:淡黄色粉末或鳞片状晶体。无水物:棕色片状晶体
2. 密度(g/mL 25ºC):3.55
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):1001
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,5.2kPa):未确定
7. 折射率(n20/D):未确定
8. 闪点(ºC,):未确定
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值(25℃):未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:易溶于水,也溶于乙醇和氨水。
毒理学数据
急性毒性:LD50:369mg/Kg(大鼠经口);186mg/Kg(兔经口)
生态学数据
对水是极其危害的,若无政府许可,勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:3
8.表面电荷:0
9.复杂度:2.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.如果遵照规格使用和储存则不会分解。
2.避免接触氧化物,水分/潮湿。经升华过的产品比较稳定,缓慢吸收水分。粉末状产品易潮解,在空气中迅速变绿。溶于水、乙醇、乙二醇和氨水。
3.镍试剂具有毒性和致癌性,使用时一定要小心谨慎。
贮存方法
储存在阴凉,干燥的地方
合成方法
1. 在磨口烧瓶中放入NiCl2·6H2O粉末,注入亚硫酰氯(SOCl2)以覆盖粉末,装上回流冷凝管,加热回流数小时。用水浴蒸去过量的SOCl2。沾在产品上的SOCl2可通过将烧瓶反复抽真空来除去。
2. 将NiCl2·6H2O置于燃烧管中,在150℃下干燥,然后通入含有Cl2的HCl气流,并加热至400℃。待黄色的NiCl2生成后,将管子的一端密封,在油泵抽真空的情况下将管子加热至管子能耐受的最高温度,使产物升华。为了除去HCl,可将升华产物置于KOH上面,在160℃高真空下退火。
用途
1. 用于镀镍、制隐显墨水及用作氨吸收剂等。
2. 氯化镍可作为一个温和的路易斯酸参与反应,同时也能催化实现偶联反应,以及配合金属氢化物作为还原试剂参与选择性还原反应。
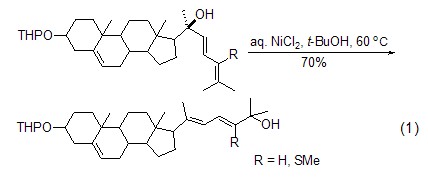
氯化镍作为一个温和的路易斯酸,可以实现二烯醇在醇水溶液中的区域选择性重排反应 (式1)[1]。该反应若在质子酸作用下则会给出脱氢产物,在其它路易斯酸如醋酸镍、氯化钯和氯化铜作用下产率都偏低,只有在氯化镍作用下才能获得高产率。
氯化镍作为路易斯酸还能催化氰基三甲基硅与α,β-不饱和缩醛的反应,得到相应的α-氰基衍生物 (式2)[2]。
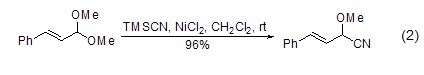
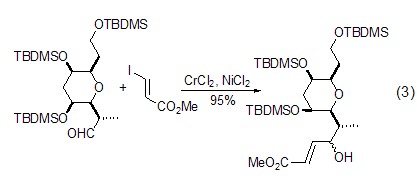
氯化镍与二氯化钴的组合,还能有效实现醛与乙烯基碘的反应,得到烯丙醇化合物 (式3)[3]。该类反应容许多种官能团如酯、酰胺、氰、酮、缩醛、醚、硅基醚、醇、烯烃和炔烃的存在,因而能有效制备多种类型的烯丙醇化合物。
在膦配体的存在下,氯化镍和二氯化钴催化体系还能实现烯炔偶联反应,如用于形成分子内烯炔环化反应 (式4)[4]。
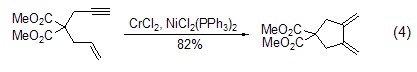
与其它金属卤化物类似,氯化镍在还原试剂如氢化铝锂作用下能转变为低价金属试剂,进而实现对多种官能团的选择性还原反应,如将烯烃还原为烷烃,将炔烃还原为顺式烯烃,以及实现N-O键的断裂反应 (式5)[5]等。
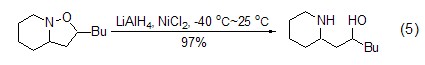
在二异丙基氢化铝DIBAL作用下,氯化镍还能实现炔烃与TMSCN的偶联反应,高产率地得到吡咯衍生物 (式6)[6]。

氯化镍在锌粉的作用下也能够转变为高活性的Ni(0),进而实现醛、烯烃和芳香硝基化合物的还原反应,如烷基、芳基和乙烯基溴与α,β-不饱和酯的还原Heck反应 (式7)[7]。
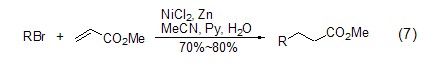
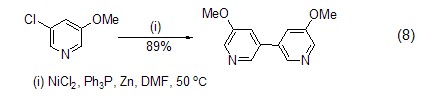
在超声以及过量三苯基膦和碘化钠存在下,氯化镍和锌粉还能实现芳基卤代物的还原自身偶联反应 (式8)[8]。
除了自身偶联反应外,氯化镍还能实现芳烃碘化物或芳基溴化物与三烷氧基磷的交叉偶联反应 (式9)[9]。

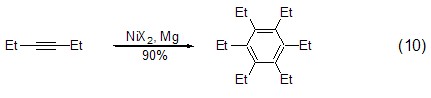
氯化镍与金属镁Mg结合组成的催化体系,能够实现对称炔烃的三聚反应,得到六取代芳烃化合物 (式10)[10],端炔在该体系催化下则会生成许多异构体。
安全信息
危险运输编码:UN3288 6.1/PG 3
危险品标志: 有毒
有毒  刺激
刺激  危害环境
危害环境
文献
1. (a) Kyler, K. S.; Watt, D. S. J. Am. Chem. Soc., 1983, 105, 619. (b) Kyler, K. S.; Bashir-Hashemi, A.; Wtt, D. S. J. Org. Chem., 1984, 49, 1084. 2. Mukaiyama, T.; Takenoshita, H. Chem. Lett., 1989, 997. 3. Aicher, T. D.; Buszek ,K. R.; Fang, F. G.; Forsyth, C. J.; Jung, S. H.; Kishi, Y.; Matelich, M. C.; Scola, P. M.; Spero, D. M.; Yeon, S. K. J. Am. Chem. Soc., 1992, 114, 3162. 4. Trost, B. M.; Tour, J. M. J. Am. Chem. Soc., 1987, 109, 5268. 5. Tufariello, J. J.; Meckler, H.; Pushpananda, K.; Senaratne, A. Tetrahedron, 1985, 41, 3447. 6. Chatani, N.; Hanafusa, T. Tetrahedron Lett., 1986, 27, 4201. 7. Sustmann, R.; Hopp, P.; Holl, P. Tetrahedron Lett., 1989, 30, 689. 8. Tiecco, M.; Tingoli, M.; Testaferri, L.; Bartoli, D.; Chianelli, D. Tetrahedron, 1989, 45, 2857. 9. Balthazor, T. M.; Grabiak, R. C. J. Org. Chem., 1980, 45, 5425. 10. Mauret, P.; Alphonse, P. J. Org. Chem., 1982, 47, 3322. 11.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无

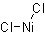



 沪公网安备 31010602001115号
沪公网安备 31010602001115号