| 物竞编号 | 0K02 |
|---|---|
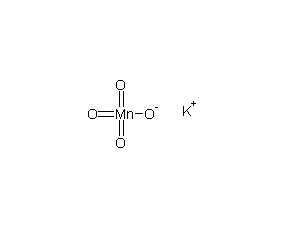
| 分子式 | KMnO4 |
| 分子量 | 156.03 |
| 标签 | 过锰酸钾, 灰锰氧, Permanganic acid potassium salt, Chameleon mineral, 漂白剂, 消毒剂, 脱臭剂, 水质净化剂, 精制剂。 |
编号系统
CAS号:7722-64-7
MDL号:MFCD00011364
EINECS号:231-760-3
RTECS号:SD6475000
BRN号:暂无
PubChem号:暂无
物性数据
1.性状:深紫色细长斜方柱状结晶,有金属光泽。[11]
2.熔点(℃):240(分解)[12]
3.相对密度(水=1):2.7[13]
4.溶解性:溶于水、碱液,微溶于甲醇、丙酮、硫酸。[14]
毒理学数据
1.急性毒性[15] LD50:750mg/kg(大鼠经口);2157mg/kg(小鼠经口)
2.刺激性 暂无资料
3.亚急性与慢性毒性[16] 与锰相似。锰的亚急性和慢性毒性为:豆状核的苍白球、尾状核和丘脑出现胶样变性;大脑也有类似变化,甚至损及脊髓和周围神经。
4.致突变性[17] DNA损伤:大肠杆菌200μmol/L。微生物致突变:其他微生物10ppm。细胞遗传学分析:小鼠乳腺1mmol/L(48h)
5.其他[18] 大鼠睾丸内最低中毒剂量(TCLo):400mg/kg(1d,雄性),引起雄性生育指数改变。
生态学数据
1.生态毒性[19]
LC50:3.6mg/L(96h)(金鱼)
LC50:0.75mg/L(96h)(斑点叉尾鮰)
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率:无可用的
7、单一同位素质量:157.881414 Da
8、标称质量:158 Da
9、平均质量:158.0339 Da
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:4
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积74.3
7.重原子数量:6
8.表面电荷:0
9.复杂度:118
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.溶于水成深紫红色溶液,遇乙醇、过氧化氢则分解。加热至240 ℃以上放出氧气。强氧化剂,在酸性介质中还原成 Mn2+,碱性或中性介质中还原为二氧化锰,与 Mn2+作用生成二氧化锰,反应过程中均放出氧。与浓硫酸接触易发生爆炸,在冷却情况下,与浓硫酸作用析出高锰酸酐黑绿色的油状液体。与有机物接触、摩擦、碰撞,因受热放出氧会引起燃烧。工作人员应做好防护,若不慎触及眼睛,应立即用大量流动清水冲洗。工作环境应具有良好的通风条件。在240℃下分解。水溶液为深紫红色,呈中性。在100g水中的溶解度为2.83g(0℃)、6.51g(20℃)、32.35g(75℃)。本品为强氧化剂,与易燃物混合,一经摩擦即着火爆炸。
2.吸入后可引起呼吸道损害。溅落眼睛内,可刺激结膜, 使眼介质着色, 重者致灼伤。刺激皮肤, 浓溶液或结晶对皮肤有腐蚀性。口服腐蚀口腔和消化道,出现口内烧灼感、上腹痛、恶心、呕吐、口咽肿胀等。口服剂量大者,口腔黏膜呈棕黑色、肿胀糜烂,剧烈腹痛,呕吐,血便,休克,最后死于循环衰竭。
3.具有极强的氧化性,应保存在玻璃容器、铁质容器或者聚乙烯容器中。
4.稳定性[20] 稳定
5.禁配物[21] 强还原剂、活性金属粉末、硫、铝、锌、铜及其合金、易燃或可燃物。硫酸、铵盐、过氧化氢、甘油,乙二醇、磷等
6.避免接触的条件[22] 受热
7.聚合危害[23] 不聚合
8.分解产物[24] 氧化钾、氧化锰
贮存方法
储存注意事项[25] 储存于阴凉、干燥、通风良好的专用库房内。远离火种、热源。库温不超过30℃,相对湿度不超过80%。包装密封。应与还原剂、活性金属粉末、酸类等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
合成方法
1.焙烧法:氢氧化钾熔融脱水,与软锰矿粉混合,经冷却粉碎后,在240 ℃温度下,吸收空气中的氧,氧化焙烧缓慢地转化为锰酸钾,用水或稀溶液浸取后,压滤,配制电解液组成为:锰酸钾160~180 g/L。氢氧化钾(游离)45~60 g/L、碳酸钾<60 g/L。电解终点控制电解液中锰酸钾40~60 g/L,氢氧化钾(游离)90~110g/L,经离心分离得高锰酸钾粗品,再经重结晶、 离心分离、干燥制得高锰酸钾成品。
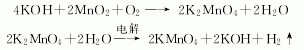
离心分离后的母液经蒸发回收锰酸钾,经苛化回收氢氧化钾。
2.液相氧化法:氢氧化钾经预热,在200 ℃以上吹入富氧空气或空气,与软锰矿粉进行液相氧化反应,二氧化锰先氧化成亚锰酸钾,再进一步氧化生成锰酸钾。氢氧化钾浓度控制在60%~70%,与二氧化锰的摩尔比值为(30~60)∶1。锰酸钾经沉降分离,上层氢氧化钾回收,再经析晶、压滤、用电解母液溶解,并加入氢氧化钙溶液苛化,然后压滤后配制电解液进行电解,高锰酸钾粗品离心分离,再经重结晶、离心分离、干燥制得高锰酸钾成品。
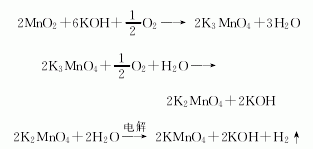
离心分离后的母液,经蒸发回收锰酸钾,再经苛化回收氢氧化钾。
3.将80g氢氧化钾和40g氯酸钾加入到直径为6~8cm的铁制坩埚中。加热熔融后移去火焰。在搅拌下,用铁勺分数次加入80g的二氧化锰粉末(这时稍有发泡,但无关系)。等全部加完后,再次加热坩埚。可缓缓加热至成暗红热状态,同时进行激烈搅拌(否则,熔融物将不能从坩埚取出)。暗红热状态约保持5min,然后放置令其自然冷却。将固化的熔融物粉碎,溶于1.5L的沸水中,连续通入二氧化碳使之变成高锰酸盐。可取一滴液体放在滤纸上,检查MnO2-4的绿色是否消失而变成MnO-4的红紫色。若转化完全,过滤,将滤液加热浓缩直至开始析出结晶。生成的结晶(粗制品)用玻璃过滤器滤出。浓缩母液时还可再得结晶。合并两部分结晶并进行重结晶。收量为50~60g。
精制法:在制备氧化滴定用的高锰酸钾标准溶液时,系将市售的高锰酸钾溶于蒸馏水中,在接近沸点下加热约1h。冷却后用玻璃过滤器过滤,溶液以储存在棕色瓶中为宜。制成的纯高锰酸钾水溶液,即使保存1~3年,其浓度几乎无变化。但若含锰(Ⅱ)则不稳定,故必须用加热的方法使有机物等还原性物质全部除去。
4.碳化法:将软锰矿粉与熔融氢氧化钾混合,经冷却、粉碎后,在280~320℃温度下,吸收空气中的氧,转化为锰酸钾,然后用水或母液(渣水)浸取,得锰酸钾溶液,再以二氧化碳处理,即得高锰酸钾。
5.电解法:将锰酸钾溶液电解即得高锰酸钾。锰酸钾溶液的制法同碳化法。电解法的最大优点是锰酸钾利用率高,劳动生产率高,燃料消耗少;而碳化法则具有设备简单,不需要消耗大量电流等特点。目前在工业中以电解法生产为主。目前锰酸钾的制取已采用一步法新工艺。
6.在100kg工业品高锰酸钾中,加入280kg蒸馏水,采用不锈钢管插入溶液底部,通蒸汽加热至全部溶解。趁热过滤。将滤液加盖,让其自然冷却结晶,待溶液温度降至室温时,取出母液,将陶缸中结晶的上面一半离心甩干做一级品,下面的一半甩干做二级品,将甩干的成品放入盘中,先在80℃下烘至快干,再将温度升高到90~110℃,烘干过程中必须搅拌,防止表面层分解。母液可浓缩至结晶大部分析出,做为原料,也可不浓缩直接用来溶解工业品。
用途
1.在化学品生产中,广泛用作氧化剂,如用作制糖精,维生素C、异烟肼及安息香酸的氧化剂;在医药上用作防腐剂、消毒剂、除臭剂及解毒剂;在水质净化及废水处理中,作水处理剂,以氧化硫化氢、酚、铁、锰和有机、无机等多种污染物,控制臭味和脱色;在气体净化中,可除去痕量硫、砷、磷、硅烷、硼烷及硫化物;在采矿冶金方面,用于从铜中分离钼,从锌和镉中除杂,以及化合物浮选的氧化剂;还用作特殊织物、蜡、油脂及树脂的漂白剂,防毒面具的吸附剂,木材及铜的着色剂等。食品级用作漂白剂、消毒剂、脱臭剂、水质净化剂及饮料用二氧化碳的精制剂。有强氧化作用,可除臭消毒,医药工业用作防腐剂、消毒剂、除臭剂和解毒剂等。
2.在化学品生产中,广泛用作氧化剂,如用作制糖精、维生素C、异烟肼及安息香酸的氧化剂;医药中用作防腐剂、消毒剂、除臭剂及解毒剂;在水质净化及废水处理中,作水处理剂,以氧化硫化氢、酚、铁、锰和有机、无机等多种污染物,控制臭味和脱色。还用作漂白剂、吸附剂、着色剂及消毒剂等。在混凝土外加剂中用作膨胀剂。
3.用作分析试剂,如配制氧化性标准溶液,作氧化剂。还用于有机合成,漂白纤维及作杀菌剂。
4.高锰酸钾在塑料电镀中可用于某些材质的化学粗糙化处理,也可用于线路板制造孔金属化的孔壁处理。在铝及合金的钝化处理中,可代替六价铬进行金色钝化处理,亦可用作铝及合金化学抛光的添加剂。在溶液分析中,高锰酸钾是重要的滴定试剂,可用于过氧化氢、亚铁盐等的氧化还原滴定分析。
5.高锰酸钾 (KMnO4) 是一种有机合成中常用的廉价的氧化试剂。由于它溶于水,因此常用于水相或者水与其它溶剂混合相的氧化反应中。高锰酸钾的水溶液是很强的氧化剂,向溶液中加入酸会增加其氧化性。在相转移试剂的存在下,高锰酸钾可以在非极性的溶剂如CH2Cl2中反应。研究发现,高锰酸钾也能吸附在固体试剂上,因此它可以作为有效的异质氧化剂。
氧化反应 高锰酸钾易溶于水,其水溶液是强的氧化剂,可以广泛用于氧化各种无机物或有机物,这是高锰酸钾最初的用途。高锰酸钾的水溶液可以氧化醛、醇、胺等多种有机化合物[1,2]。在一定条件下,高锰酸钾溶液甚至可以氧化烷烃生成酮 (式1)[3]。酸性或碱性高锰酸钾溶液的氧化性更强,能参与很多氧化反应[4]。

在有机溶剂中,高锰酸钾也具有很强的氧化性,将芳香烃衍生物氧化成芳香羧酸,也可以氧化烯[5]等。比如可以氧化1,4-二氢吡啶生成相应的吡啶衍生物[6]。高锰酸钾与液氨组成的体系可以氧化与羧基相邻的α-C而生成相应的醇 (式2)[7]。
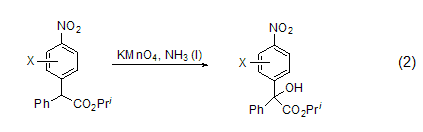
高锰酸钾具有比较强的吸附性,可以吸附在固体上,作为氧化剂参与固相反应。例如,它可以吸附在硅藻土上异相氧化醇,该反应条件温和、时间短、产率高;高锰酸钾与湿的SiO2结合,是一种有效的廉价氧化剂,可以将缩二氨基脲氧化成羧酸 (式3)[8]。
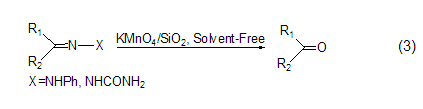
高锰酸钾本身是强氧化剂,其氧化的选择性较差。但是它与其它物质结合在一起后,有时就具有一定的选择性,可以选择性地氧化某些基团,这大大扩展了高锰酸钾的应用。比如高锰酸钾与ZrOCl2构成的氧化系统就具有选择性,在温和条件下可有效地氧化二级醇,而不氧化一级醇;高锰酸钾与CuSO4或者Al2O3结合,经过一定条件的处理,可以作为氧化剂选择性地氧化烷基化合物 (式4~式6)[9]。

利用高锰酸钾的氧化性可以完成一些在一般条件下难以进行的反应。比如它可以氧化二烯类化合物生成呋喃环二醇类化合物 (式7)[10]。
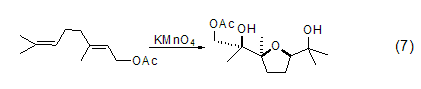
6.主要用作消毒剂、氧化剂、漂白剂、毒气吸收剂、二氧化碳精制剂、水净化剂等。[26]
安全信息
危险运输编码:UN 1490 5.1/PG 2
危险品标志: 氧化剂
氧化剂  有害
有害  危害环境
危害环境
文献
1. Lukasz, K.; Maciej, S.; Lech, S. Tetrahedron, 2000, 12, 2247. 2. Tietze, L. F.; Zhou, Y.; Topken, E. Eur. J. Org. Chem., 2000, 12, 2247. 3. Nguyen, P.; Corpuz, E.; Heidelbaugh, T. M.; Chow, K.; Garst, M. E. J. Org. Chem., 2003, 68, 10195. 4. Tsotinis, A.; Vlachou, M.; Kiakos, K.; Hartley, J. A.; Thurston, D. E. Chem. Lett., 2003, 32, 512. 5. Kara, Y.; Balci, M. Tetrahedron, 2003, 59, 2063.. 6. Xia, J. J.; Wang, G. W. Synthesis, 2005, 14, 2379. 7. Mieczyslaw, M.; Krystyna, K. T.; Maciej, P.; Malgorzata, B. Tetrahedron, 2005, 61, 11952. 8. Hajipour, A. R.; Adibi, H.; Ruoho, A. E. J. Org. Chem., 2003, 68, 4553. 9. Shaabani, A.; Bazgir, A.; Teimouri, F.; Lee, D. G. Tetrahedron Lett., 2002, 43, 5165. 10. Travis, B.; Borhan, B. Tetrahedron Lett., 2001, 42, 7741. [1~10]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [11~26]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无



 沪公网安备 31010602001115号
沪公网安备 31010602001115号