| 物竞编号 | 0JZY |
|---|---|
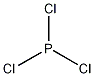
| 分子式 | PCl3 |
| 分子量 | 137.35 |
| 标签 | 氯化磷, 氯化磷(Ⅲ), Phosphorus trichloride |
编号系统
CAS号:7719-12-2
MDL号:MFCD00011438
EINECS号:231-749-3
RTECS号:TH3675000
BRN号:969177
PubChem号:24853774
物性数据
1.性状:无色澄清液体,在潮湿空气中发烟。[11]
2.熔点(℃):-111.8[12]
3.沸点(℃):76[13]
4.相对密度(水=1):1.57(21℃)[14]
5.相对蒸气密度(空气=1):4.75[15]
6.饱和蒸气压(kPa):13.33(21℃)[16]
7.临界压力(MPa):5.67[17]
8.辛醇/水分配系数:2.01[18]
9.溶解性:可混溶于二硫化碳、乙醚、四氯化碳、苯。[19]
毒理学数据
1.急性毒性[20]
LD50:550mg/kg(大鼠经口)
LC50:582.4mg/m3(大鼠吸入,4h)
2.刺激性 暂无资料
3.亚急性与慢性毒性[21] 大鼠吸入浓度33.5mg/m3,60d,出现体重增长缓慢和皮肤溃疡等。
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
4.其他有害作用[22] 该物质对环境有危害,应特别注意对水体的污染。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:135.880319 Da
8、标称质量:136 Da
9、平均质量:137.3328 Da
计算化学数据
1、疏水参数计算参考值(XlogP):2.3
2、氢键供体数量:0
3、氢键受体数量:0
4、可旋转化学键数量:0
5、互变异构体数量:无
6、拓扑分子极性表面积(TPSA):0
7、重原子数量:4
8、表面电荷:0
9、复杂度:8
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:1
性质与稳定性
1.露于潮湿空气中能水解成亚磷酸和氯化氢,发生白烟而变质。遇乙醇和水起分解反应。与氧作用生成三氯氧磷,与氯作用生成五氯化磷,与有机物接触会着火。易燃。易刺激黏膜,有腐蚀性。有毒!失火时,可用干砂土、干粉灭火器扑救,不可用水。
2.具有强烈的吸湿性,对空气和湿气敏感,遇水会发生剧烈反应并产生酸。在密闭的容器中遇水时会发生爆炸,应在通风橱中进行操作。该试剂具有很强的毒性,吸入体内对肺部和呼吸道造成严重的伤害、甚至可能致死。
3.稳定性[23] 稳定
4.禁配物[24] 强碱、强氧化剂、水、酸类、醇类、钾、钠、金属氧化物
5.避免接触的条件[25] 潮湿空气
6.聚合危害[26] 不聚合
贮存方法
储存注意事项[27] 储存于阴凉、干燥、通风良好的专用库房内,实行“双人收发、双人保管”制度。远离火种、热源。库温不超过30℃,相对湿度不超过75%。包装必须密封,切勿受潮。应与氧化剂、酸类、碱类、食用化学品分开存放,切忌混储。不宜久存,以免变质。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
1.以试剂级三氯化磷为原料,加入石英蒸馏设备中,在常压下,于馏出温度为74~76℃时进行蒸馏,去掉初馏分及终馏分,就几乎可以除掉砷、硫、其他金属,制得纯度为99.99%~99.999%左右的高纯三氯化磷成品。其反应式如下: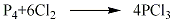
2.反应装置是一只1000mL双颈圆底烧瓶,一颈装有进气管,从氯气钢瓶中放出的氯气经过安全瓶和盛有浓硫酸的洗气瓶(也作计泡器)由此导入,另一颈安装蒸馏头,它的支管处套一小接收瓶封住,顶端安装一带有五氧化二磷干燥管的130cm长的水冷凝管。取200g在浓硫酸的干燥器中干燥了数天的红磷放入烧瓶中,用250mL三氯化磷盖住(构成极易流动的悬浮体)缓慢加热,当猛烈沸腾时开始加入氯气。继续在保持反应物猛烈沸腾下,加入453g氯气(由钢瓶减少的重量求得)。氯气加完后改成蒸馏装置,将三氯化磷蒸馏出来。
3.以试剂级三氯化磷为原料,加入石英蒸馏设备中,在常压下,于馏出温度为74~76℃时进行蒸馏,去除初馏分及终馏分,就几乎可以除去砷、硫和其他金属,制得纯度为99.99%~99.999%左右的高纯三氯化磷成品。
用途
1.用作半导体掺杂剂及高纯磷的原料。在整个电路生产的工艺过程中,三氯化磷的质量对控制沾污、提高集成电路成品率起着重要作用。
2.主要用作制造敌百虫、敌敌畏、甲胺磷、乙酰甲胺磷、稻瘟净等有机磷农药的原料。也是制造三氯硫磷、三氯氧磷、亚磷酸、磷酸三苯酯和磷酸三酚酯的原料。医药工业用于生产磺胺嘧啶(S.D.),磺胺五甲氧嘧啶(SMD)等药物的中间体。染料工业作缩合剂,用于生产色酚类染料。还用作生产香料的氯化剂和催化剂。
3.作半导体掺杂剂,并用作制备高纯磷的原料。也用作半导体参杂源。
4.三氯化磷是一种氯代试剂,能够与氧杂、氮杂、硫杂、双烯等化合物剧烈反应,也可与有机金属化合物、金属盐反应,是合成含磷金属配体的磷源[1~3]。
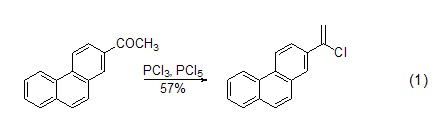
作为氯代化试剂 醇、醛、酮和羧酸可以用三氯化磷氯代化。醛、酮可转化为亚磷酸酯。羧酸可转化为酰氯。PCl3和Br2组合使用时,羧酸发生α-溴代反应。例如芳香酮的氯化后产物是氯代的烯烃 (式1)[4]。
与胺的反应 三氯化磷与二级胺反应可以得到二氯亚磷酰胺中间体 (式2)[5]。

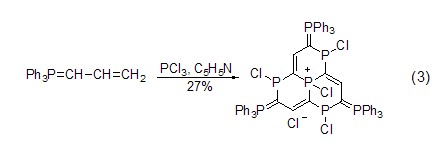
合成磷杂环 三氯化磷与Wittig试剂反应可以得到磷杂环化合物 (式3)[6]。
手性配体的合成 三氯化磷可作为磷源用于合成一些含磷的配体,如下列化合物可作为手性催化配体的合成 (式4,式5)[7~10]。

5.用于制造有机磷化合物,也用作试剂等。[28]
安全信息
危险运输编码:暂无
危险品标志: 极毒
极毒  腐蚀
腐蚀
安全标识:S26 S45 S36/S37/S39
危险标识:R14 R29 R35 R26/28 R48/20
文献
1. Kpies, P.; Kehr, G.; Froehlich, R.; Erker, G.; Grimme, S. Organometallics, 2005, 24, 4742. 2. Wan, X.; Sun, Y.; Luo, Y.; Li, D.; Zhang, Z. J. Org. Chem., 2005, 70, 1070. 3. Baillie, C.; Zhang, L.; Xiao, J. J.Org. Chem., 2004, 69, 7779. 4. Sarobe, M.; Jenneskens, L. W.; Steggink, Ralph G. B.; Visser, T. J. Org. Chem., 1999, 64, 3861. 5. Liedtke, J.; Loss, S.; Alcaraz, G.; Gramlich, V.; Grutzmacher, H. Angew. Chem., Int. Ed., 1999, 38, 1623. 6. Breitsameter, F.; Polborn, K.; Schmidpeter, A. Eur. J. Inorg. Chem., 1998, 1907. 7. Duursma, A.; Boiteau, J.-G.; Lefort, L.; Boogers, J. A. F.; de Vries, A. H. M.; de Vries, J. G.; Minnaard, A. J.; Feringa, B. L. J. Org. Chem., 2004, 69, 8045. 8. Xin, L. H.; Potnick, R.; Johnson, J. S. J. Am. Chem. Soc., 2004, 126, 3070. 9. Monti, C.; Gennari, C.; Piarulli, U. Tetrahedron Lett., 2004, 45, 6859. 10. Tissot-Croset, K.; Polet, D.; Alexakis, A. Angew. Chem., Int. Ed., 2004, 43, 2426. [1~10]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [11~28]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号