| 物竞编号 | 0K64 |
|---|---|
| 分子式 | CuBr |
| 分子量 | 143.45 |
| 标签 | 溴化亚铜, 一溴化铜, Copper bromide, Copper(I) bromide, Cuprous bromide, copperbromide(cubr), Coppermonobromide, Copperbromideoffwhitepowder, Cupper(Ⅰ) bromide, 高纯度化合物, 催化剂 |
编号系统
CAS号:7787-70-4
MDL号:MFCD00010969
EINECS号:232-131-6
RTECS号:暂无
BRN号:暂无
PubChem号:24855364
物性数据
1. 性状:白色立方结晶粉末,,易潮解成绿色至暗蓝色粉末,在空气中慢慢氧化成绿色粉末。
2. 密度(g/mL 25ºC):4.72
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):497
5. 沸点(ºC,常压):1136
6. 沸点(ºC,5.2kPa):未确定
7. 折射率(n20/D):未确定
8. 闪点(ºC,):1345
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值(25℃):未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性(mg/mL):溶于氢溴酸、盐酸、硝酸和氨。热水中分解。不溶于丙酮、醋酸及沸浓硫酸。
毒理学数据
暂无
生态学数据
对水是稍微危害的,若无政府许可,勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:2
8.表面电荷:0
9.复杂度:2
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.如果遵照规格使用和储存则不会分解。
2.避免接触水分/潮湿,光,空气。溶于氢溴酸、盐酸、硝酸和氨。热水中分解。不溶于丙酮、醋酸及沸浓硫酸。溴化亚铜不溶于水,但可溶于氢卤酸、硝酸和氨水。
3.在干燥氮气或氩气下保存,放置于阴凉处。与二甲基硫醚形成的配合物CuBr-DMS应严格密封防止二甲基硫醚脱落。
贮存方法
在干燥氮气或氩气下保存,放置于阴凉处。
合成方法
将硫酸铜和溴化钾溶液混合,然后加入二氧化硫反应,反应物经洗涤、过滤、干燥后制得溴化亚铜成品。将按上式计量的硫酸铜和溴化钾,溶于充分煮沸过的蒸馏水中,然后将溶液过滤。往滤液中急速的通入纯二氧化硫,最初两小时内滤液保持微热,然后经充分冷却后边搅拌边通气,使溴化亚铜的微小淡黄色结晶沉淀出来。在避光的条件下,将沉淀过滤出来,并用充分煮沸且通入二氧化硫的蒸馏水作为洗涤液洗涤结晶数次,最后再用含二氧化硫的纯乙醇,纯乙醚洗涤。生成物先置于硫酸和氢氧化钠上干燥3~4h,然后在氢气流中干燥,最后进行真空干燥。
用途
1.用于彩色照相、电池。用作有机反应催化剂及尼龙稳定剂。
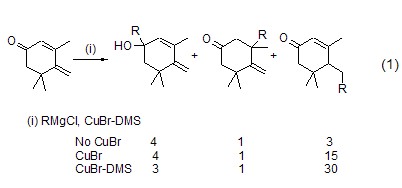
2.溴化亚铜是有机Cu(I) 试剂或有机Cu(II)试剂的前体,能够用于合成多种烷基或芳基铜试剂(如二丁基铜锂、二苯基铜锂等)[1]。由于CuBr试剂中不可避免地会混有微量的Cu(II)盐 (因而显淡绿色或淡蓝色),因而使用最多的是与二甲基硫醚配位后的CuBr-DMS配合物。在比较多种铜试剂如CuCl、CuI、CuOTf和CuBr·DMS的平行实验中,证明CuBr-DMS具有最好的效果。而且采用这种Cu(I)配合物作为有机铜试剂的合成前体,也能产生与CuBr本身更好的效果,如烯酮的1,6-加成、1,4-加成和1,2-加成反应 (式1)[2],不加入铜试剂与加入不同的铜试剂能产生完全不同的效果。
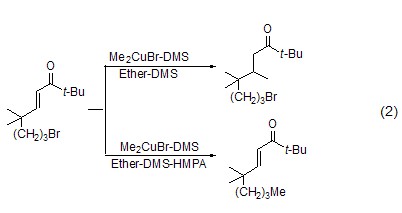
以CuBr或CuBr·DMS为初始原料的有机铜化学与溶剂的选择有关。如末端带有长链烷基溴取代基的烯酮在二甲基铜锂和溴化锂作用下,在乙醚-DMS溶剂中发生共轭加成反应;然而加入HMPA后,则只发生卤素置换反应 (式2)[3]。
对于二硫代酸酯,使用格氏试剂和烷基锂试剂通常会发生亲硫加成反应,但是采用有机铜试剂则会发生亲碳加成反应 (式3)[4]。CuBr可用于制备反应底物二硫代酸酯,而由CuBr-DMS制备而来的有机铜试剂则能产生特异的亲碳加成反应。

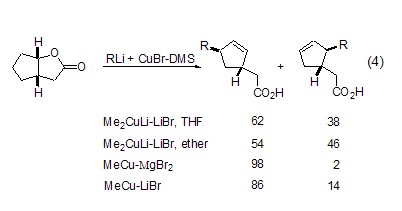
通常CuBr或CuBr-DMS都是伴随经典有机金属试剂如格氏试剂或烷基锂参与反应的,不同的有机金属试剂与CuBr-DMS的组合,也能获得不同的反应结果 (式4)[5]。
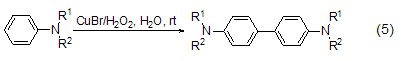
虽然CuBr参与的氧化反应很少,但CuBr与双氧水的结合可以用于苯胺衍生物的氧化偶联反应 (式5)[6]。该反应不但能在水相中进行,而且对多种苯胺底物适用,并且不会存在底物在水中不溶解的问题。
安全信息
危险运输编码:暂无
危险品标志: 刺激
刺激
危险标识:R36/37/38
文献
1. (a) Lipshutz, B. H.; Sengupta, S. Org. React., 1992, 41, 135. (b) Rossiter, B. E.; Swingle, N. M. Chem. Rev., 1992, 92, 771. (c) Chapdelaine, M. J.; Hulce, M. Org. React., 1990, 38, 225. (d) Posner, G. H. An Introduction to Synthesis Using Organocopper Reagents; Wiley: New York, 1980. 2. Bertz, S. H.; Gibson, C. P.; Dabbagh, G. Tetrahedron Lett., 1987, 28, 4251.. 3. House, H. O.; Lee, T. V. J. Org. Chem., 1978, 43, 4369. 4. Westmijze, H.; Kleijn, H.; Meijer, J.; Vermeer, P. Synthesis, 1979, 432. 5. Curran, D. P.; Chen, M.-H.; Leszczweski, D.; Elliott, R. L.; Rakiewicz, D. M. J. Org. Chem., 1986, 51, 1612. 6. Jiang, Y.; Xi, C.; Yang, X. Synlett, 2005, 1381. 7.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无

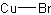



 沪公网安备 31010602001115号
沪公网安备 31010602001115号