| 物竞编号 | 0QPQ |
|---|---|
| 分子式 | NaBH3CN |
| 分子量 | 62.84 |
| 标签 | Sodium cyanotrihydroborate, NaBH3CN |
编号系统
CAS号:25895-60-7
MDL号:MFCD00003516
EINECS号:247-317-2
RTECS号:暂无
BRN号:4152656
PubChem号:24849595
物性数据
1. 性状:白色粉末
2. 密度(g/mL,25/4℃):1.199
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):240~242
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,5.2kPa):未确定
7. 折射率:未确定
8. 闪点(ºC):未确定
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kpa,20ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:溶于水,易溶于甲醇,溶于四氢呋喃,微溶于乙醇、异丙胺,不溶于乙醚、苯、己烷。
毒理学数据
易燃,有毒,有腐蚀性
生态学数据
对水是危害的,若无政府许可,勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积23.8
7.重原子数量:4
8.表面电荷:0
9.复杂度:34.5
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.如果遵照规格使用和储存则不会分解。
避免接触氧化物,酸,水分/潮湿。
2.具有较大的吸湿性。
贮存方法
在干燥氮气或氩气氛围下储存。
合成方法
1.就所用原料的不同,NaBH4的合成方法可分为四类:以硼烷或有机硼为原料;以三卤化硼及四氟硼酸钠为原料;以硼酸酯为原料;以氧化硼、磷酸硼及硼酸盐为原料。
氢化钠硼酸甲酯法 将硼酸和适量甲醇加入精馏釜中,徐徐加热,在54℃全回流2h,然后收集硼酸甲酯与甲醇共沸液。共沸液经硫酸处理,精馏后可得较纯产物。将由氢气与钠作用而得的氢化钠送入缩合反应罐中,在搅拌下加热至220℃左右开始加硼酸甲酯,至260℃时停止加热。加料温度控制在280℃以下,加料后继续搅拌,使其充分反应。反应完成后冷却至100℃以下,离心分离,得缩合产物滤饼。在水解器中加入适量的水,将滤饼缓慢加入水解器中,控制温度在50℃以下,加料完毕后升温至80℃,离心分离,水解液则送入分层器中,静止1h后自动分层,下层水解液即为硼氢化钠溶液。其反应式如下:
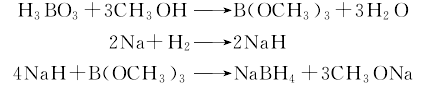
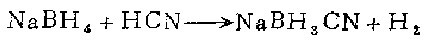
2. 注意!本制备使用氢氰酸,共溶液的配制和反应均应在通风橱中进行。
在清洁、干燥的2升三颈园底烧上安装恒压滴液漏斗、空气趋动机械搅拌器和回流冷凝器。冷凝器的出口连接盛i摩尔氢氧化钠溶液的洗气瓶,以除去带出的氢氰酸蒸气,然后到气量计测量产生的氢量。氢气通入通风橱。
在烧瓶中放1000毫升四氢呋喃(预先用CaH2干燥,用前过滤)和80.2克(2 .09摩尔)98.5%氯化硼钠。用干燥氮气清扫烧瓶。在滴液漏斗中盛16.7%(重量比)氢氰酸在四氢吠喃(294克,含58.8克或2.33摩尔98%氢氰酸)的溶液。此系统简单地再次清扫。将氢氰酸溶液慢慢地在室温下加到搅拌下的氢化湖钠浆状物中,立即缓慢地放出氢。由于反应微微放热,用水浴使烧瓶保持在25℃。在搅拌下1小时后将混合物逐渐加热至回流,直到氢不再发生。反应混合物冷至窒温后,用氮气清扫然后抽空。少量的不溶固体用垫活性炭的滤纸过滤。透明的淡黄色滤液在旋转真空蒸发器中干燥。在加热前先除去大约一半的溶液,最后在60℃真空下千燥。氰基氢化硼钠(120克)为白色固体,产率91%。此产物经元素分析可能含B(OH)3杂质。将此粗产品溶于四氢映喃 (20%V/V)中,过滤,加4倍过量的二氯甲烷,两次重结晶即得纯品。
用途
1.有机合成用还原剂,醛、酮、肟、烯胺类还原。
2.可用作塑料、橡胶及其胶黏剂的发泡剂,醛、酮、酰氯等有机物的还原剂,乙烯聚合催化剂,纸张和纤维等的色调改进剂,含汞污水处理剂,制双氢链霉素的氢化剂,以及用作制造硼氢化钾、硼烷等的原料。
3.还原剂。选择地还原脂肪酮和醛成烃,还原烯胺成胺,缩醛酮成醚,Mannich碱成甲基化合物。与甲醛合用使胺或肼甲基化。在HMPT中还原碘代烷和对甲苯磺酸脂成烃,亚砜成硫醚。还用于还原胺化。
4.氰基硼氢化钠 (NaBH3CN) 在现代有机合成中被用作温和的选择性还原试剂。它可以还原亚胺、亚铵盐、肟以及肟的衍生物、腙和烯胺,可以将羰基通过磺酸基腙还原性地去氧化;可以还原醛、酮、极化的烯烃、烷基卤化物、环氧化物、缩醛、烯丙基酯基团[1]。
NaBH3CN是一个受反应体系酸碱度控制的试剂。在酸性条件下还原能力最强,例如在体系pH < 4时,可以将醛和酮还原成为相应的醇。但是,由于该试剂价格比NaBH4昂贵许多,所以该功能被后者所覆盖。在体系pH = 5~8之间时,该试剂对醛和酮还原非常慢。但在此条件下,它能够快速地还原亚胺和亚胺离子,其它官能团如:酯和内酯、硝基、卤化物或者环氧化合物均不受到影响[2]。
然而,在pH = 5的酸度下,醛和酮可以与伯胺和仲胺生成亚铵离子,所以造就了醛和酮被还原胺化的适当条件。还原胺化反应是该试剂的特征反应,是有机化学中最常用的从醛和酮制备胺的方法之一。该反应一般在甲醇溶液中进行,用HCl、乙酸或者其它缓冲试剂来调节pH值。通常在室温下反应数小时至数十小时即可完成,产率在中等至较高水平 (式1,式2)[2~7]。使用二羰基化合物与手性氨基酚反应时,则可以得到多环化合物 (式3)[8]。
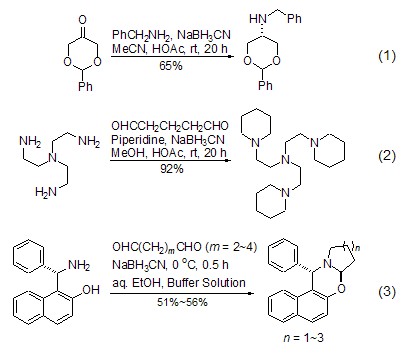
路易斯酸对该反应有催化作用[5~8]。如果使用路易斯酸催化时,体系的pH值受到路易斯酸的调控则可以直接进行反应。常用的路易斯酸试剂有TiCl4、ZnCl2和Ti(O-iPr)3,Ti(O-iPr)3,由于最易操作而得到广泛的应用(式4,式5)[9,10]。

安全信息
危险运输编码:UN 3179 4.1/PG 2
危险品标志: 易燃
易燃  极毒
极毒  危害环境
危害环境
安全标识:S26 S28 S45 S60 S61 S36/S37/S39
危险标识:R11 R32 R34 R20/21/22 R50/53
文献
1. 综述文献见:Lane C. F. Synthesis, 1975, 135. 2. Borch, R. F.; Bernstein, M. D.; Dupont Durst, H. J. Am. Chem. Soc., 1971, 93, 2897. 3. Holmberg, P.; Sohn, D.; Leideborg, R.; Caldirola, P.; Zlatoidski, P.; Hanson, S.; Mohell, N.; Rosqvist, S.; Nordvall, G.; Johansson, A. M.; Johansson, R. J. Med. Chem., 2004, 47, 3927. 4. Barili, P. L.; Berti, G.; Catelani, G.; D'Andrea, F.; De Rensis, F.; Puccioni, L. Tetrahedron, 1997, 53, 3407. 5. Bonnet, V.; Duval, R.; Tran, V.; Rabiller, C. Eur. J. Org. Chem., 2003, 4810. 6. Vincent, S. P.; Lehn, J-M.; Lazarte, J.; Nicolau, C. Bioorg. Med. Chem., 2002, 10, 2825. 7. Doyle, M. P.; Yan, M.; Phillips, I. M.; Timmons, D. J. Adv. Synth. Catal., 2002, 344, 91. 8. Lu, J. Xu, X., Wang, S., Wang, C., Hu, Y., Hu, H. J. Chem. Soc., Perkin Trans 1., 2002, 2900. 9. Rahman, O.; Kihlberg, T.; Langstroem, B. Org. Biom. Chem., 2004, 2, 1612. 10. Angelovski, G.; Costisella, B.; Kolaric, B.; Engelhard, M.; Eilbracht, P. J. Org. Chem., 2004, 69, 5290. 11.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号