| 物竞编号 | 0KSN |
|---|---|
| 分子式 | ZnI2 |
| 分子量 | 319.22 |
| 标签 | Hydriodic acid zinc salt (2:1), 高纯度化合物, 消毒剂, 收敛剂 |
编号系统
CAS号:10139-47-6
MDL号:MFCD00011299
EINECS号:233-396-0
RTECS号:暂无
BRN号:暂无
PubChem号:24865631
物性数据
1. 性状:白色、无味的颗粒状固体。
2. 密度(g/mL,25/4℃): 4.736
3. 相对蒸汽密度(g/mL,空气=1):无可用
4. 熔点(ºC):446
5. 沸点(ºC,常压):625
6. 沸点(ºC,5.2kPa): 无可用
7. 折射率: 无可用
8. 闪点(ºC): 625
9. 比旋光度(º): 无可用
10. 自燃点或引燃温度(ºC): 无可用
11. 蒸气压(kPa,25ºC): 无可用
12. 饱和蒸气压(kPa,60ºC): 无可用
13. 燃烧热(KJ/mol):无可用
14. 临界温度(ºC): 无可用
15. 临界压力(KPa): 无可用
16. 油水(辛醇/水)分配系数的对数值:无可用
17. 爆炸上限(%,V/V):无可用
18. 爆炸下限(%,V/V): 无可用
19. 溶解性:溶于水、甘油,在醇和乙醚中能无限溶解。
毒理学数据
在皮肤和粘膜上造成腐蚀性影响,刺激皮肤和粘膜。
生态学数据
该物质对环境可能有危害,对水体应给予特别注意。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:317.738066 Da
8、标称质量:318 Da
9、平均质量:319.2179 Da
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:3
8.表面电荷:0
9.复杂度:2.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.遵照规格使用和储存不会分解。碘化锌溶于水、乙醇、丙酮和液氨等,微溶于乙醚。置于空气中见光变为棕色。在1150℃左右时,碘化锌蒸气开始分解成锌(或ZnI)和碘。加热时可被氢还原,与氧作用生成ZnO和碘。在室温下与氧和水反应生成ZnO和碘。此外,它还能将硫酸还原成SO2,并放出碘。
2.碘化锌具有很强的吸湿性和光敏感性,应在避光环境中置于干燥处保存。
贮存方法
密封干燥避光保存
合成方法
1.可用金属锌与碘直接加热反应,或碘化钡与硫酸锌复分解反应,或碘的乙醚溶液在锌存在的情况下回流,减压除乙醚后在400度升华制备。
2.在圆底烧瓶中,加入由电解所得到的高纯锌粉6.5g,碘晶体20g及水70mL,经充分振荡混合后静置一段时间。当碘的颜色褪去后,滤出剩余的锌粉,并将滤液蒸发浓缩至10mL左右。然后把容器移入盛有H2SO4和氮气保护的真空干燥器内进行干燥。当有结晶析出时,再将其移入盛有NaOH和氮气保护的真空干燥器内继续干燥。最后将所得晶体置于耐热玻璃容器中加热至300~350℃,经真空升华即可制得纯度较高的ZnI2产品。
3.将1份锌粉,2~4份碘(视锌粉的纯度而定)和10份无水乙醚置于圆底烧瓶中,加热回流。在液体初始的颜色消失后,停止回流,用砂芯漏斗滤出残留的Zn-ZnO,然后在减压下,温热产物以除去乙醚,最后在400℃左右升华而得碘化锌纯品。
4.在冷却条件下将锌粉、碘和水混合,搅拌下进行反应,控制温度不超过60℃:
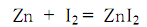
反应结束后,再加入少量锌,并加热至溶液变为无色,过滤,滤液加热浓缩,在温度低于95℃下减压蒸发干燥至结晶松散,即为成品。
用途
1.医疗上用作局部防腐消毒剂、收敛剂;用于碘淀粉试剂以测定亚硝酸盐;用作游离氯和其他氧化剂的试剂。
2.碘化锌通过转移金属化反应能有效制备有机锌试剂,同时作为一个温和路易斯酸也能促进加成反应和取代反应的发生。
碘化锌能与有机金属试剂如有机锂、有机镁和有机铜等发生转移金属化反应,得到有机锌试剂,进而作为亲核试剂参与钯催化的对烷基碘化合物等碳阳离子试剂的碳-碳键形成偶联反应 (式1)[1]。
碘化锌与重氮甲烷作用也为合成Simmons- Smith试剂(碘代碘甲基锌)提供了一种新的方法 (式2)[2]。

作为一个温和的路易斯酸,碘化锌也能催化活泼二烯底物和亲二烯底物如呋喃与烯丙基甲酯间的Diels-Alder环加成反应 (式3)[3]。

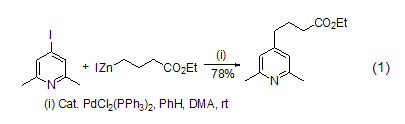
碘化锌也能用于活化碳杂原子双键C=X,如通过螯合效应活化官能化的羰基,进而高度立体选择性地实现与硅基乙烯酮缩醛的羟醛缩合反应 (式4)[4]。
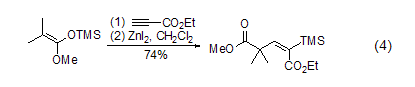
碘化锌与炔烃在二氯二茂钛的催化作用下反应生成烯基锌试剂,该物质进一步和其它亲电试剂反应生成多取代烯烃化合物 (式5)[5]。

碘化锌的路易斯酸性也使得它可以活化多种碳-杂原子C-X键,进而实现亲核取代反应。如环醚在碘化锌作用下能够与RSSiMe3或RSeSiMe3试剂发生亲核取代,得到开环后的C-S键或C-Se键形成产物 (式6)[6]。
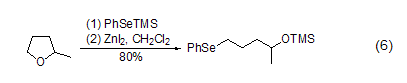
碘化锌与氮杂环丙烷作用可以高选择性地得到碘代的开环产物 (式7)[7]。
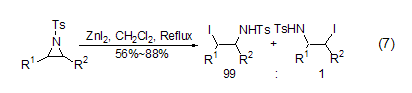
碘化锌与还原剂如氰基硼氢化钠组合能够将烯丙基或芳基的酮、醛和醇还原为相应的饱和烃化合物 (式8)[8]。

安全信息
危险运输编码:暂无
危险品标志: 腐蚀
腐蚀
安全标识:S26 S45 S36/S37/S39
危险标识:R34
文献
1. Sakamoto, T.; Nishimura, S.; Kondo, Y.; Yamanaka, H. Synthesis, 1988, 485. 2. (a) Wittig, G.; Schwarzenback, K. LA, 1961, 650, 1. (b) Wittig, G.; Wingher, F. LA, 1962, 656, 18. 3. Brion, F. Tetrahedron Lett., 1982, 23, 5239. 4. Quendo, A.; Rousseau, G. Tetrahedron Lett., 1988, 29, 6443. 5. Gao, Y.; harada, K.; Hata, T.; Urabe, H.; Sato, F. J. Org. Chem., 1995, 60, 290. 6. Miyoshi, N.; Hatayama, Y.; Ryu, I.; Kambe, N.; Murai, T.; Murai, S.; Sonoda, Synthesis, 1988, 175. 7. Ghorai, M. K.; Das, K.; Kumar, A.; Ghosh, K. Tetrahedron Lett., 2005, 46, 4103. 8. Lau, C. K.; Dufresne, C.; Belanger, P. C.; Pietre, S.; Scheigetz, J. J. Org. Chem., 1986, 51, 3038. 9.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无



 沪公网安备 31010602001115号
沪公网安备 31010602001115号