| 物竞编号 | 0KP6 |
|---|---|
| 分子式 | HBr |
| 分子量 | 80.91 |
| 标签 | 溴氢酸, Hydrogen bromide, 掩蔽剂, 烷基化催化剂 |
编号系统
CAS号:10035-10-6
MDL号:MFCD00011323
EINECS号:233-113-0
RTECS号:MW3850000
BRN号:3587158
PubChem号:24851252
物性数据
1.性状:无色透明至淡黄色发烟液体,具有刺激性酸味。[1]
2.熔点(℃):-86(纯品)[2]
3.沸点(℃):126(47%)[3]
4.相对密度(水=1):1.49(47%)[4]
5.相对蒸气密度(空气=1):2.8[5]
6.溶解性:与水混溶,可混溶于乙醇、乙酸。[6]
毒理学数据
1.急性毒性[7]
LD50:76mg/kg(大鼠静脉)
LC50:9460mg/m3(大鼠吸入,1h);2694mg/m3(小鼠吸入,1h)
2.刺激性 暂无资料
3.亚急性与慢性毒性[8] 长期接触,表现为慢性呼吸道刺激症状和消化功能障碍。
生态学数据
通常对水体是稍微有害的,不要将未稀释或大量产品接触地下水,水道或污水系统,未经政府许可勿将材料排入周围环境。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:79.926155 Da
8、标称质量:80 Da
9、平均质量:80.9119 Da
计算化学数据
1、疏水参数计算参考值(XlogP):1
2、氢键供体数量:0
3、氢键受体数量:0
4、可旋转化学键数量:0
5、互变异构体数量:无
6、拓扑分子极性表面积(TPSA):0
7、重原子数量:1
8、表面电荷:0
9、复杂度:0
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:1
性质与稳定性
1.暴露于空气中或日光下会因溴游离而使色泽逐渐变暗。氢溴酸具有强还原性、强酸性,微发烟。能被空气中的氧及其他氧化剂氧化为元素溴,能与甲氧基作用生成溴甲烷,与碱生成溴化物,与胺生成氢溴酸盐。易溶于氯苯、二乙氧基甲烷有机溶剂,能与水、醇 或乙酸混溶。具有较强的腐蚀性。遇H发泡剂立即燃烧。遇氰化物能产生剧毒的氰化氢气体。与碱金属能发生剧烈反应。与脂肪胺、链烷醇胺、烯基氧化物、芳香胺、氨基化合物、氨、氢氧化铵、碱、氧化钙、环氧氯丙烷、氟、异氰酸酯、发烟硫酸、有机酸酐、硫酸、四硼氢化钠、强氧化剂、醋酸乙烯酯、水不能配伍。腐蚀绝大多数金属,形成极易燃的氢气。除白金、金和钽等金属外,对其他金属皆腐蚀,生成金属溴化物。
2.工作人员要做好防护,若不慎触及皮肤和眼睛,应立即用流动的清水冲洗。工作环境应有良好的通风条件。液化时成为浅黄色液体。纯品在空气中较稳定,但遇光及热易被氧化而游离出溴。遇臭氧能发生爆炸性反应。高毒。溶于水,水溶液为强酸称氢溴酸。溶于醇。应使吸入气体的患者脱离污染区,安置休息并保暖。如眼睛污染用大量水冲洗,严重者须就医诊治。皮肤污染时先用大量水冲洗,严重者须就医诊治。
3.稳定性[9] 稳定
4.禁配物[10] 碱类、氨、活性金属粉末、易燃或可燃物、氰化物
5.避免接触的条件[11] 潮湿空气
6.聚合危害[12] 不聚合
7.分解产物[13] 溴化氢
贮存方法
储存注意事项[14] 储存于阴凉、通风的库房。远离火种、热源。库温不超过30℃,相对湿度不超过80%。保持容器密封。应与易(可)燃物、碱类、活性金属粉末等分开存放,切忌混储。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
1.赤磷法 先将赤磷放入盛水的反应器中,在搅拌下缓慢加入溴素,反应生成氢溴酸和亚磷酸,通过沉降、过滤、蒸馏制得氢溴酸成品。其反应方程式如下: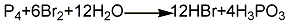
2.二氧化硫法 将二氧化硫通入加有溴和碎冰的反应釜中,保持温度在20℃以下进行反应直至溶液呈黄色。将混合溶液进行蒸馏,蒸出溶液加入氢氧化钡溶液与生成的硫酸反应,生成硫酸钡沉淀。经静置,过滤,除去沉淀,再蒸馏滤液即得氢溴酸成品。其反应方程式如下: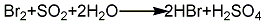
3.溴素与氢气在活性炭催化剂存在下直接合成溴化氢。然后蒸馏、提纯,制得溴化氢。其反应式如下: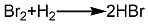
4.在催化剂FeBr3存在下,将苯溴化。在烧瓶中放置200g无水苯和几克溴化铁(或铁粉),然后,将烧瓶用涂石蜡的塞子,塞好,塞子上插有滴液漏斗和排气管,经滴液漏斗缓慢加入135mL溴(在负压下)。这时会发生激烈反应(烧瓶应用水冷却),并均匀地放出溴化氢。出来的气体通过一U型管,它的一端装满FeBr3以吸收苯,另一端装满蒽以结合带出来的溴。溴与含水的红磷作用。在烧瓶中放10g红磷,20mL水。经滴液漏斗在负压下缓慢加入35mL溴。为了将出来的气体提纯,使它通过一个充满石棉与含水(但不是湿的)红磷混合物的U型管。被提纯的氢溴酸用氯仿萃取,分去水相进行蒸馏。62℃时蒸出少量氯仿,在125~126℃蒸出氢溴酸(相对密度1.473)。
5.在200毫升水中加入120克粉末状的溴化钾。将容器放在冷水中,并缓侵地加入90毫升浓硫酸(1.7克分子)。温度应不使超过75℃,否则就会生成少量的游离澳。不过,生成少t的嗅并不重要,因为它将在蒸馏过程中随沸点为100-115℃之间的馏份而蒸馏出来。将溶液冷却至室温,并在玻芯漏斗中滤出酸式硫酸钾。将滤液放在500毫升蒸馏瓶中,装上水冷凝器和接受器,并放在铁丝网上加热。溶液中有0.01一0.015%的硫酸根离子并无妨碍,将比恒沸混合物沸点低1℃,开始馏出的蒸镭液保留起来。当温度下降时应立即停止蒸馏。溶液的比重是会改变的,因为蒸馏液的组成会随着大气压力而发生改变,所得产率约为85%。将低沸点的馏份进行再蒸馏就可以增大产率。 如果需要不含硫酸根离子的值沸液,在比恒沸液馏出温度低5℃时即开始收集蒸馏液,将这个酸进行再蒸馏,并仅收集在恒沸点时馏出的溶液以获得比重最大的恒沸酸。在第二次蒸馏之前加入氢氧化钡并不能制得更纯些的产物。产率约近似地为计算量的86%。 将氢溴酸与氯化亚锡一道蒸馏,可得无色的氢溴酸。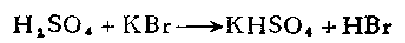
用途
1.是制造各种无机溴化物如溴化钠、溴化钾、溴化锂和溴化钙等和某些烷基溴化物如溴甲烷、溴乙烷等的基本原料。医药上用以合成镇静剂和麻醉剂等。也是一些金属矿物的良好溶剂,用于高纯金属的提炼。石油工业用作烷氧基和苯氧基化合物的分离剂、脂环烃及链烃氧化为酮、酸或过氧化物的催化剂。也用于合成染料和香料等。
2.用于无机和有机溴化物的制造;还用于合成香料、染料等。
3.用作分析试剂,如作掩蔽剂。有机和无机溴化物的合成。高纯金属的提炼。烷基化催化剂。
4.用于制造无机溴化物和有机溴化物,用作分析试剂、触媒及还原剂。[15]
安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
[1~15]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号