| 物竞编号 | 03F4 |
|---|---|
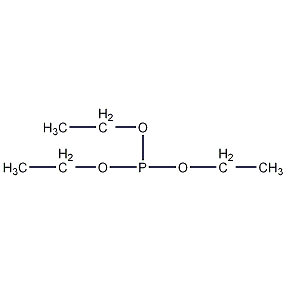
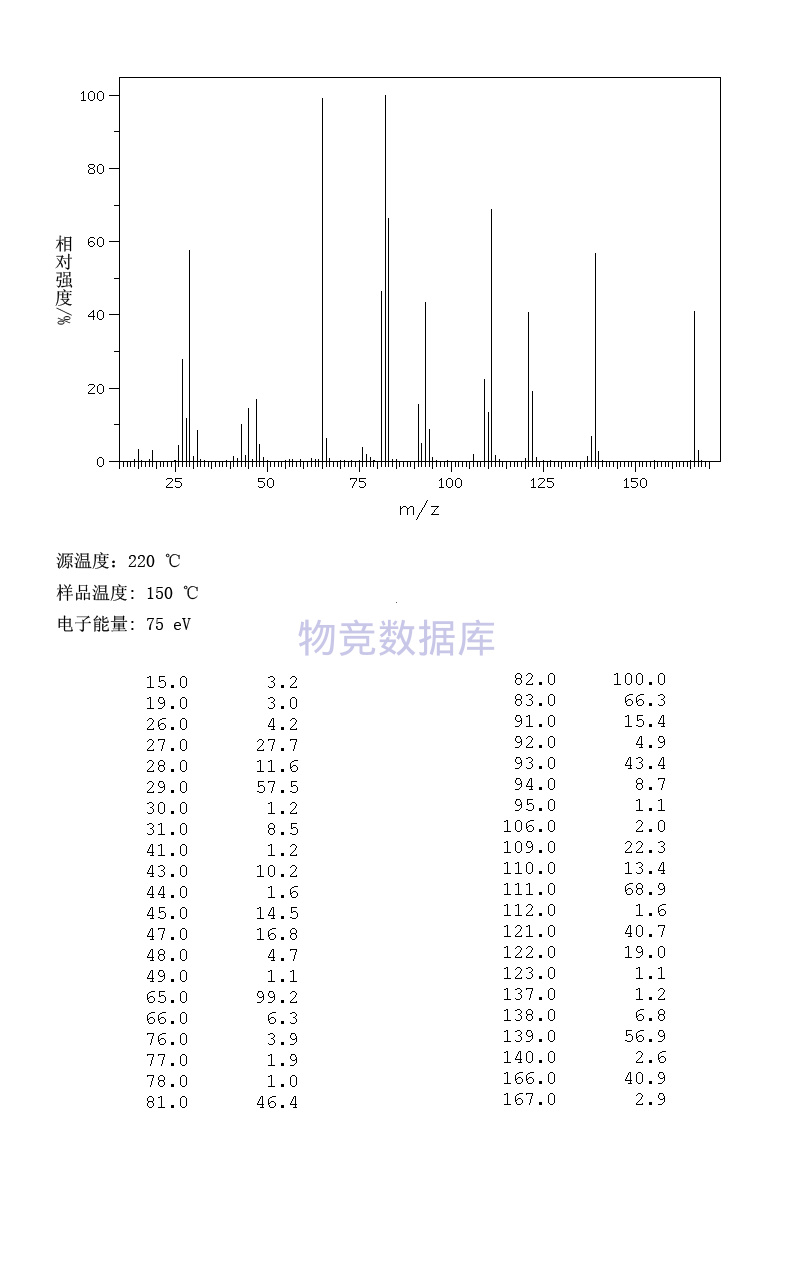
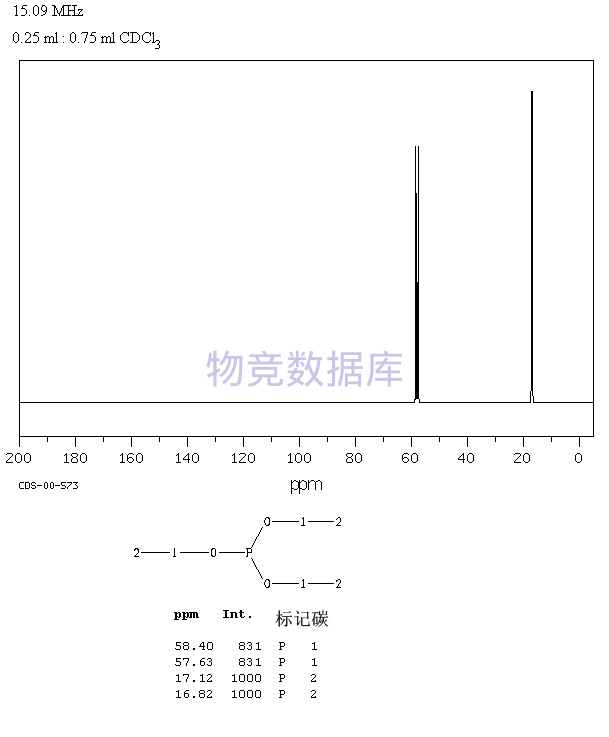
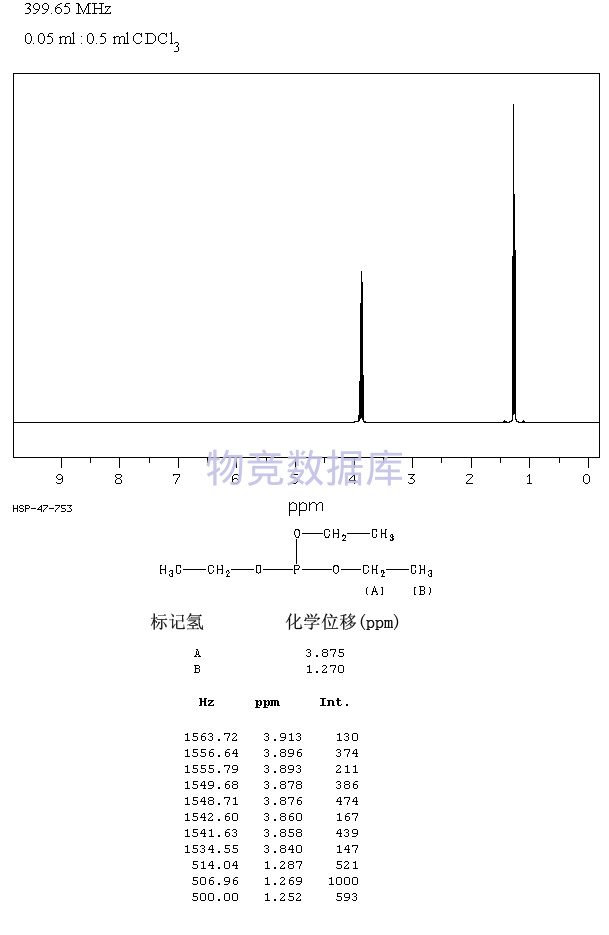
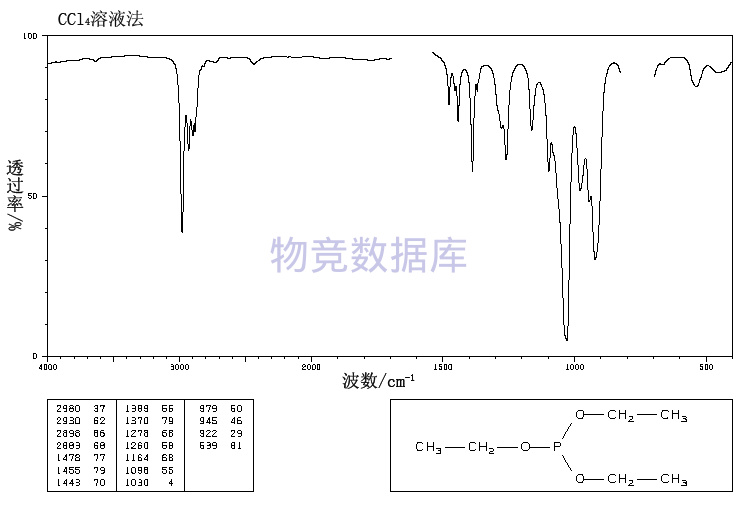
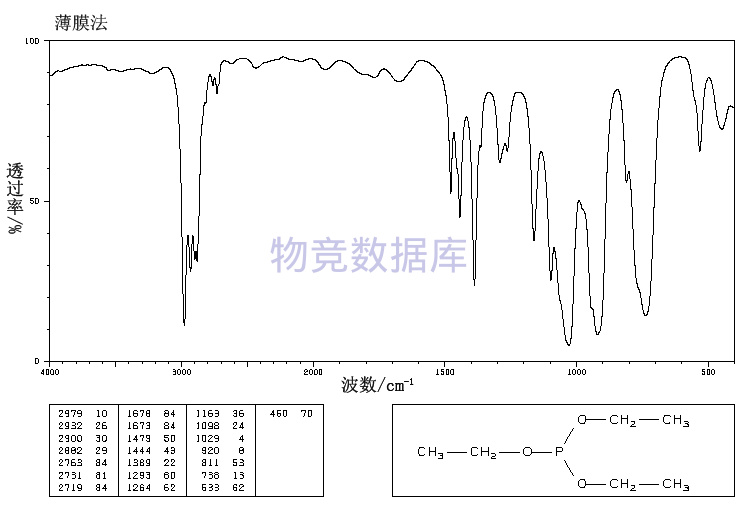
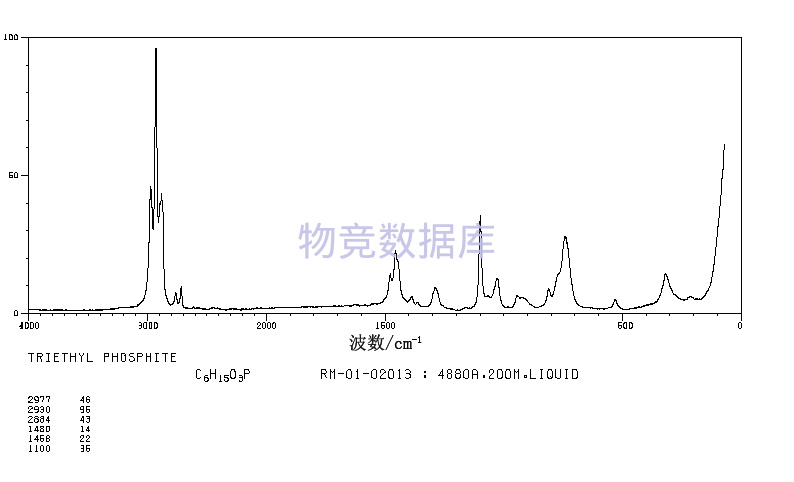
| 分子式 | C6H15O3P |
| 分子量 | 166 |
| 标签 | 脂肪族羧酸及其衍生物 |
编号系统
CAS号:122-52-1
MDL号:MFCD00009084
EINECS号:204-552-5
RTECS号:TH1130000
BRN号:956578
PubChem号:24889381
物性数据
1. 性状:无色液体
2. 相对密度(g/mL ,20/4℃):0.963
3. 折射率(nD20):1.4133
4. 闪点(℃):54
5. 熔点(℃):-112
6. 沸点(ºC,常温):157.9
7. 沸点(ºC,1.6kpa):49
8. 溶解性:易溶于乙醇、乙醚等有机溶剂,不溶于水,在水中易逐渐水解成亚磷酸二乙酯,在酸性介质中水解加快。
毒理学数据
1、急性毒性:
大鼠经口LD50:1840mg/kg;
大鼠吸入LC5O:11063mg/m3/6H;
小鼠经口LD50:3720mg/kg;
小鼠吸入LC5O:6203mg/m3/6H;
小鼠经腹腔膜LD:>500 mg/kg;
兔子皮肤LD50:2800mg/kg
生态学数据
对水稍有危害。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):1.2
2.氢键供体数量:0
3.氢键受体数量:3
4.可旋转化学键数量:6
5.互变异构体数量:无
6.拓扑分子极性表面积27.7
7.重原子数量:10
8.表面电荷:0
9.复杂度:55.7
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
在常温和常压比较稳定。由于该试剂具有非常特殊的不愉快气味,建议反应在通风橱中进行。
贮存方法
1.储存于阴凉、通风仓库中。远离火种、热源。
2.本品用铁桶包装。贮存于阴凉干燥处,并用氮气保护。按有毒化学品规定贮运。
合成方法
1.以无水乙醇、三氯化磷和液氨为原料在二甲苯溶剂中进行酯化反应,生成亚磷酸三乙酯,粗酯经水洗去除氯化铵及亚磷酸二乙酯,蒸馏脱溶剂后,再经精馏得成品。原料消耗定额:三氯化磷(95%)950kg/t、无水乙醇930kg/t、液氨340kg/t。
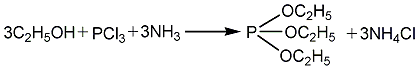
2.在装有封闭搅拌器、高效回流冷凝器、500毫升滴液漏斗的3升三颈烧瓶中,放入138克(175毫升,3摩尔)绝对乙醇和1升干燥石油醚(沸点40一60℃)中有447克(477毫升,3摩尔)新蒸的二乙苯胺溶液。滴液漏斗中放入400毫升干燥石油醚和137.5克(87.5毫升,1摩尔)新蒸的三氯化磷溶液。烧瓶在冷水浴中冷却。在剧烈搅拌下,滴加三氯化磷i容液,滴入速度以混合物温和回流即可。滴完约需30分钟。加完后继续加热搅拌使温和回流1小时。将含有大量盐酸二乙苯胺沉淀的悬浮物冷却,用玻芯漏斗在水泵上吸滤压干胺盐滤饼,用5份100毫升干燥石油醚(沸点40一60℃)洗涤。合并滤液和洗涤液,在水浴上用75厘米长的松针形分馏柱蒸馏浓缩。残余物转移到梨形烧瓶中,用75厘米长的松针形分馏柱在水泵减压下蒸馏。蒸出少量前馏分之后,在57-58℃/16mm收集产品(51一52℃/13mm,43一44℃/10mm无色产品的产量为138克(83%)
木制法用二甲基苯胺亦可,生成的盐酸盐极易滤去,且不吸潮。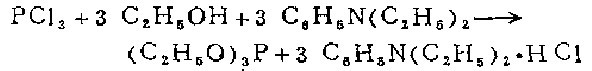
用途
1.本品用作塑料稳定剂和增塑剂;也用作医药、农药的中间体。用来生产镇痛药苯噻啶、农药杀螟威等;也用作增塑剂、稳定剂、润滑油和润滑脂的添加剂。
2.制麟酸酪(Arbuzow反应)。脱氧、脱硫剂。氢过氧化物、过氧二芳甲酰、环氧化物、异氰酸酯脱氧,1、2一二酮脱氧制炔。还原含氮官能团。环硫化物、硫醇、二硫化物脱硫。还原α一酮酸成α一羟酸。与α一卤代醛、酮生成二烷基乙烯磷酸酯(Perkow反应)。
3.亚磷酸三乙酯在有机合成中具有广泛的用途,常常被用作还原剂和亲核试剂。它直接参与的反应由于其重要性被命名为不同的人名反应。
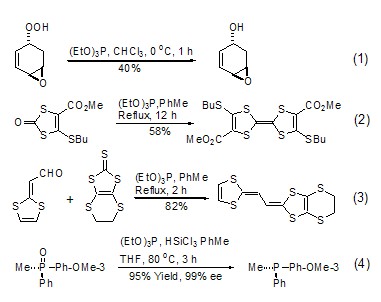
亚磷酸三乙酯作为还原剂,在反应中磷原子自身从+3价被氧化到+5价,同时伴有从另一反应物中夺取氧原子或者硫原子的功能,生成相应的磷酸三乙酯。例如:亚磷酸三乙酯可以将过氧化合物还原成醇,在控制条件下可以在二个过氧基团存在下选择性地还原其中的一个 (式1)[1]。1,3-二巯基酮在亚磷酸三乙酯存在下可以发生偶联反应 (式2)[2]。将亚磷酸三乙酯与醛和1,3-二巯基硫酮一起回流可得到相应的烯烃 (式3)[3]。文献报道,亚磷酸三乙酯还可以与其它磷酸酯发生氧交换反应 (式4)[4]。
亚磷酸三乙酯主导的人名反应之一是Arbuzov反应[5]。亚磷酸三乙酯与卤代烃首先发生亲核取代反应,同时卤离子引起乙氧基断裂生成烃基取代的膦酸二乙酯衍生物。当卤代烃中卤原子的β-位有拉电子基团时,产物在强碱的作用下生成膦叶立德,随即与醛发生“一锅煮”反应得到Horner-Emmons 反应的产物。该反应在复杂天然产物的合成中具有重要的作用 (式5)[6]。

亚磷酸三乙酯主导的另一个人名反应是Cadogan反应[7],它是多环含氮杂环化合物合成的重要方法。芳基硝基官能团与亚磷酸三乙酯共热,可以将硝基还原成氮宾。然后氮宾进攻分子内其它的烯键或者芳环,生成多环含氮杂环化合物。在Cadogan反应中,亚磷酸三乙酯一般同时兼做反应物和溶剂。例如:邻乙烯基取代硝基苯与亚磷酸三乙酯共热生成吲哚衍生物 (式6)[8,9]。邻芳基取代硝基苯与亚磷酸三乙酯共热则生成咔啉衍生物 (式7)[10,11]。

安全信息
危险运输编码:UN 2323 3/PG 3
危险品标志: 有害
有害
文献
1. Gultekin, M. S.; Salamci, E.; Balci, M. Carbohydr. Res., 2003, 338, 1615. 2. Imakubo, T.; Iijima, T.; Kobayashi, K.; Kato, R. Synth. Met., 2001, 120, 899. 3. Kageyama, T.;Ueno, S.; Takimiya, K.; Aso, Y.; Otsubo, T. Eur. J. Org. Chem., 2001, 2983. 4. Wu, H.-C.; Yu, J.-Q.; Spencer, J. B. Org. Lett., 2004, 6, 4675. 5. Bhattacharya, A. K.; Thyagarajan, G. Chem. Rev., 1981, 81, 415. 6. Yamauchi, S.; Uno, H. Org. Biomol. Chem., 2003, 1, 1323. 7. Cadogan, J. I. G.; Cameron-Wood, M.; Mackie, R. K.; Seaarle, R. J. G. J. Chem. Soc., 1965, 4831. 8. Cotterill, A. S.; Moody C. J.; Roffey, J. R. A. Tetrahedron, 1995, 51, 7223. 9. Bentley, D. J.; Fairhurst, J.; Gallagher, P. T.; Manteuffel, A. K.; Moody, C. J.; Pinder, J. L. Org. Biomol. Chem., 2004, 2, 701. 10. Kistenmacher, a.; Baumgarten, M.; Enkelmann, V.; Pawlik, J.; Mullen, K. J. Org. Chem., 1994, 59, 2743. 11. Bouchard, J.; Wakim, S.; Leclerc, M. J. Org. Chem., 2004, 69, 5705. 12.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无



 沪公网安备 31010602001115号
沪公网安备 31010602001115号