| 物竞编号 | 02UT |
|---|---|
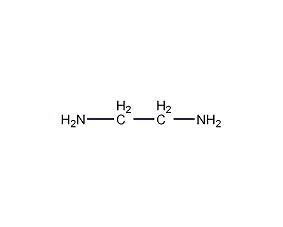
| 分子式 | C2H8N2 |
| 分子量 | 60.12 |
| 标签 | 1,2-乙二胺, 1,2-二氨基乙烷, 二氨基乙烷, 1,2-亚乙基二胺, 亚乙基二胺, 1,2-Diaminoethane, 1,2-Ethanediamine, DAE, EDA |
编号系统
CAS号:107-15-3
MDL号:MFCD00008204
EINECS号:203-468-6
RTECS号:KH8575000
BRN号:605263
PubChem号:24894420
物性数据
1.性状:无色或微黄色黏稠液体,有类似氨的气味。[10]
2.pH值:11.9(25%溶液,25℃)[11]
3.熔点(℃):8.5[12]
4.沸点(℃):116~117.2[13]
5.相对密度(水=1):0.90(20℃)[14]
6.相对蒸气密度(空气=1):2.07[15]
7.饱和蒸气压(kPa):1.43(20℃)[16]
8.燃烧热(kJ/mol):-1891.9[17]
9.临界压力(MPa):6.48[18]
10.辛醇/水分配系数:-2.04~-1.2[19]
11.闪点(℃):33.9(OC);43.3(CC)[20]
12.引燃温度(℃):385[21]
13.爆炸上限(%):16.6[22]
14.爆炸下限(%):2.7[23]
15.溶解性:溶于水、乙醇,不溶于苯,微溶于乙醚。[24]
16.黏度(mPa·s,15ºC):1.722
17.黏度(mPa·s,25ºC):1.54
18.黏度(mPa·s,30ºC):1.226
19.闪点(ºC,闭口):43.3
20.闪点(ºC,开口):33.9
21.蒸发热(KJ/mol,20ºC):46.89
22.熔化热(KJ/mol):19.34
23.生成热(KJ/mol):-26.63
24.比热容(KJ/(kg·K),30ºC,定压):2.95
25.溶解热(J/mol,15ºC):1.82
毒理学数据
1.急性毒性[25]
LD50:1298mg/kg(大鼠经口);730mg/kg(兔经皮)
LC50:300mg/m3(小鼠吸入)
2.刺激性[26]
家兔经皮:450mg,中度刺激(开放性刺激试验)。
家兔经眼:675μg,重度刺激。
3.亚急性与慢性毒性[27] 大鼠反复在本品1188mg/m3下染毒,见动物脱毛及肺、肾、肝损害;在307mg/m3下连续暴露37h未见损伤。
生态学数据
1.生态毒性[28]
LC50:115.7mg/L(96h)(黑头呆鱼);230mg/L(48h)(虹鳟鱼,一年生);0.88mg/L(48h)(水蚤)
IC50:0.08~0.85mg/L(72h)(藻类)
2.生物降解性[29] MITI-I测试,初始浓度100ppm,污泥浓度30ppm,4周后降解39%~94%。
3.非生物降解性[30] 空气中,当羟基自由基浓度为5.00×105个/cm3时,降解半衰期为6h(理论)。
分子结构数据
1、摩尔折射率:18.38
2、摩尔体积(cm3/mol):68.9
3、等张比容(90.2K):169.7
4、表面张力(dyne/cm):36.8
5、极化率:7.28
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:2
3.氢键受体数量:2
4.可旋转化学键数量:1
5.互变异构体数量:无
6.拓扑分子极性表面积52
7.重原子数量:4
8.表面电荷:0
9.复杂度:6
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.化学性质:在空气中放置时吸湿,或吸收二氧化碳生成氨基甲酸盐(白色固体)。化学性质活泼,溶于水放热,水溶液呈强碱性。与无机酸生成结晶性、水溶性的盐。其硝酸盐加热时脱去2分子水,生成具有爆炸性的乙二硝胺。
2.与有机酸、酯、酸酐或酰卤反应,生成一取代酰胺或二取代酰胺。将一取代酰胺加热时,缩合生成2-烷基咪唑啉。与二元酸缩合生成聚酰胺树脂。与卤代烷反应得到一烷基或二烷基乙二胺。与丙烯腈反应,生成腈乙基化合物。与环氧化合物反应,生成加成化合物。与醛反应主要生成(Schiff)碱。与甲醛作用得到组成复杂的混合物。与氯代乙酸反应得到乙二胺四乙酸盐(EDTA),是一种有用的螯合剂。与尿素、碳酸二乙酯、光气或二氧化碳反应,主要生成2咪唑啉酮。在镍、钴或铜催化剂存在下加热到350℃生成哌啶。与二硫化碳反应生成二硫代乙二氨基甲酸,加热脱去硫化氢得到聚硫脲树脂。
3.稳定性[31] 稳定
4.禁配物[32] 酸类、酰基氯、酸酐、强氧化剂
5.聚合危害[33] 不聚合
6.分解产物[34] 氨
贮存方法
储存注意事项[35] 储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。包装要求密封,不可与空气接触。应与氧化剂、酸类等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
1、二氯乙烷法:由二氯乙烷与氨直接合成,在钼钛不锈钢反应管道内进行,反应温度控制在160~190℃,压力为2.452 MPa,反应时间1.5min,反应后的合成液经蒸发一部分水分和过量氨进人中和器,用30%碱液中和,然后经浓缩、脱盐、粗馏得粗乙二胺、粗三胺、粗多胺等混合物,最后再将粗乙二胺在常压精馏得乙二胺成品,其含量70%,在加压下蒸馏可得90%纯度的产品。反应方程式如图:
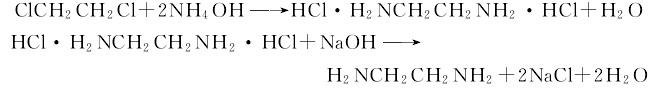
2、乙醇胺法:将乙醇胺、氨和循环物料蒸发成气相混合物通入固定床反应器,反应在氢气流中进行,反应温度为300℃,压力为25 MPa,反应生成物部分冷凝后分出气相的氨和氢气,经压缩返回反应器,液相反应物经脱氨后脱水塔后进入精馏塔,从塔顶蒸出乙二胺和哌嗪,进一步分解得乙二胺成品。
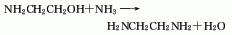
3、单乙醇胺胺化法:将乙醇胺、催化剂和水加入反应器中,催化剂(Ni5132p、G49B)用量为100ml液体中含有5g。用氮气吹扫反应器中的空气。并用氨吹扫掉氮气,然后依次把氨、氢加入反应器内。在反应温度160-240℃、压力9.81-29.42MPa下反应5-10h,而得粗品,再经后处理而得成品,转化率为50%。
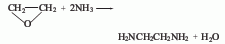
4、采用强0固体酸为催化剂,以二氯乙烷和过量的氨为原料制备乙二胺。(1)催化剂的制备:以一定浓度的氯化铵溶液与Na型分子筛(Na-MOR)在回流搅拌离子交换器中加热回流4-12h,抽滤,烘干得NH4-MOR。再与一定量活性氧化铝混合,造粒,打成片状催化剂(冲压压力≈19.6MPa),片剂厚度1.5-2.0mm,于500℃煅烧得强固体酸催化剂,该催化剂为强酸性择性催化剂。(2)乙二胺的合成:反应在通用型常压固定床催化剂反应装置中进行。原料NH3和载气惰性气体N2,在预热混合器中混合预热至一定温度后通入催化反应器中。在反应温度320-390℃,催化剂装量为单乙醇胺的1%,NH3/NEA摩尔比为36-70,NH3的压力0.5-0.7MPa,主要生成乙二胺和哌嗪(PIP)。(3)产物的分解:反应产物中含有NH3、水、乙二胺、哌嗪、乙醇胺及其他一些副产物。首先采用简单精馏方法,[在100℃前蒸馏出NH4+环乙胺+少量水;再在100-118℃蒸出乙二胺+水;继续在120-140℃之间蒸出其他高沸点副产物。由于乙二胺与水形成共沸物,因此采用萃取、恒沸等特殊分馏方法,才能达到产品要求。哌嗪脱除结晶水,采用锌粉共精馏法或以烃类作共沸剂共沸蒸馏,可得无水哌嗪。未反应完的乙醇胺和氨经分离后可以返回系统重复使用。
精制方法:于乙二胺中加入10%粒状氢氧化钠或氢氧化钾,振动数小时除去大部分水分和二氧化碳后,再用金属钠(2%~3%),分子筛或液态钠钾合金等适当的干燥剂加热回流3小时后分馏。乙二胺与水虽能形成共沸混合物,但其共沸点比乙二胺沸点只高约2℃,故不宜用共沸蒸馏脱水。可以加入与水形成共沸混合物而与乙二胺不形成共沸混合物的第三种溶剂如苯、二异丙醚、哌啶等进行蒸馏精制。
5、在二氯乙烷中加入氨水,加热至115~120℃反应。将反应溶液蒸发至开始有结晶,过滤、用乙醇洗涤。再于氮气浴中蒸馏得无水乙二胺。
用途
与金属离子形成配合物 1,2-二氨基乙烷与重金属离子可形成稳定的配合物。在金属或DAE定量分析中可以用DAE与CdII、CoII、CuII或HgII形成配合物。可以用1,2-二氨基乙烷制备的带有2n氮原子的10~18个原子的大环与金属离子生成多配位基的配合物,这些配合物在催化反应中用于特殊产物的制备[1]。铬(II)盐与DAE反应很容易制备还原剂,而DAE能大大提高CrII的还原能力,可将一级烷基卤化物还原成烷烃,将芳基溴化物或碘化物还原成芳烃。
还原反应 在THF中,B2H2与DAE按1:1比例形成的配合物是一种高选择性的还原剂,与硼氢化钠有相同的反应活性。在KI3的DAE溶液中可以发生苯酚、苯胺、酪氨酸、吡咯和羟基苯甲酸的碘代。锂与DAE体系是一种强的还原体系,可还原烯烃、芳香烃、苯酚和醇等。
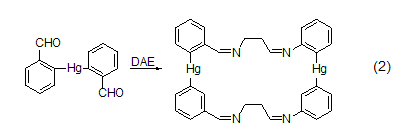
DAE可以与亲电试剂反应生成单或双的衍生物。DAE可用作对称的结构单元来形成1,2-二氨基、1,2-二亚氨基、1,2-二酰氨基、二酰亚胺或二亚甲基将分子片段连接 (式2)[3]。
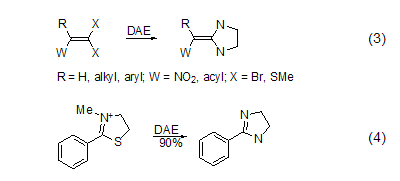
在两个原子杂环体系的合成中DAE是非常好的试剂。与1-卤代炔烃发生相似的反应可生成2-亚烷基咪唑啉或2-烷基咪唑啉。DAE和R(W)C=CX2类型的化合物反应生成取代的2-亚甲基咪唑啉 (式3)[4]。DAE与酸、酯、酰胺、二硫代酯、亚氨基、腈、2-芳基唑啉或2-苯基噻唑盐反应,生成2-取代咪唑啉 (式4)[5]。
DAE与CS2反应可生成咪唑啉-2-硫醇。DAE与乙酸三步反应可生成2-甲基咪唑。DAE与O-烷基硫代氨基甲酸酯或N-烷基二硫代氨基甲酸酯反应可生成环状胍。这些化合物也可由亚氨基卤化物或异硫氰酸酯的二烷基硫缩醛与DAE反应来制得 (式5)[6]。
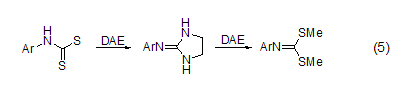
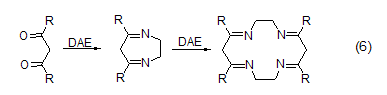
DAE与二醛、二酮、二羧酸及其衍生物反应生成包括有(N-C-C-N)片段的环状化合物 (式6)[7]。1,2-二羰基化合物 (α-二酮、o-醌、烷基草酸酯) 会生成二氢吡嗪,而后环氧化反应生成吡嗪。
有两个反应点的分子与DAE反应生成双环产物 (式7,式8)[8,9]。由此方法制备的杂环包括吡咯[1,2-a]咪唑、咪唑[3,4-a]咪唑、咪唑[1,2-b]喹啉、咪唑[1,2-c]嘧啶等。

6.用于有机合成和农药、活性染料、医药、环氧树脂固化剂等的制取。[36]
安全信息
危险运输编码:UN 1604 8/PG 2
危险品标志: 腐蚀
腐蚀
安全标识:S23 S26 S45 S36/S37/S39
文献
1. Mandal, S. K.; Nag, K. J. Org. Chem., 1986, 51, 3900. 2. Balova, I. A.; Remizova, L. A.; Makarycheva, V. F.; Rumyantseva, E. G.; Favorskaya, I. A. J. Org. Chem. USSR (Engl. Transl.), 1991, 27, 55. 3. Patel, U.; Singh, H. B.; Wolmersh, G. Angew. Chem. Int. Ed., 2005, 44, 1715. 4. (a) Nguyen, N. V.; Baum, K. Tetrahedron Lett., 1992, 33, 2949. (b) Wang, X. J.; Huang, Z. T. Chem. Ber., 1990, 123, 2141. (c) Huang, Z. T.; Shi, X. Synth. Commun., 1990, 20, 1321. 5. Singh, H.; Sarin, R. Indian J. Chem., Sect. B, 1986, 25B, 81. 6. Fukada, N.; Hayashi, M.; Suzuki, Y. Bull. Chem. Soc. Jpn., 1985, 58, 3379. 7. (a) Bergeron, R. J.; Hoffman, P. J. Org. Chem., 1980, 45, 161. (b) Liao, C. C.; Hsieh, H. P.; Lin, S. Y. Chem. Commun., 1990, 545. 8. Urleb, U.; Stanovnik, B.; Tišler, M. J. Heterocycl. Chem., 1990, 27, 643. 9. Bodtke, A.; Langer, P. Tetrahedron Lett., 2004, 45, 8741. [1~9]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [10~36]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号