| 物竞编号 | 0JWJ |
|---|---|
| 分子式 | NNaO3 |
| 分子量 | 84.99 |
| 标签 | 智利硝石, 钠硝石, 盐硝, 粒硝;盐硝;发蓝粉, Chile saltpeter, Cubic niter, Soda niter, Caliche, 硝化剂, 消泡剂, 脱色剂, 澄清剂, 氧化剂 |
编号系统
CAS号:7631-99-4
MDL号:MFCD00011119
EINECS号:231-554-3
RTECS号:WC5600000
BRN号:暂无
PubChem号:24888697
物性数据
1.性状:无色透明或白微带黄色的菱形结晶,味微苦,易潮解。[1]
2.熔点(℃):306.8[2]
3.沸点(℃):380(分解)[3]
4.相对密度(水=1):2.26[4]
5.辛醇/水分配系数:-0.79[5]
6.溶解性:易溶于水、甘油、液氨,微溶于乙醇,不溶于丙酮。[6]
毒理学数据
1、
试验方法:口服
摄入剂量:14毫克/千克
测试对象:人-女人
毒性类型:急性
毒性作用:1.Cardiac -脉搏增加,血压不下降;2.肺 ,胸部或呼吸-紫绀;3.高铁血红蛋白血症,碳氧。
2、
试验方法:口服
摄入剂量:22500微克/千克
测试对象:人力-儿童
毒性类型:急性
毒性作用:高铁血红蛋白血症,碳氧。粉尘对呼吸器官和皮肤有刺激作用。
3、
试验方法:口服
摄入剂量:1267毫克/千克
测试对象:啮齿动物-鼠
毒性类型:急性
毒性作用:详细的毒副作用没有报告以外的其他致死剂量值。
4、
试验方法:口服
摄入剂量:100 mg/kg/2Y-C
测试对象:啮齿动物-鼠
毒性类型:瘤
毒性作用:模棱两可瘤代理RTECS标准。在食物中、水中、胃肠道内,特别是在婴儿的胃肠道内被还原成亚硝酸钠而具有较大的毒性。大白鼠经口LD50:1100~2000mg/kg,ADI:0~3.7mg/kg(以硝酸根离子计,FAO/WHO,1996)。硝酸钠为强氧化剂,遇可燃物着火时能助长火势。与易氧化物质、硫黄、还原剂和强酸接触时,能引起燃烧和爆炸。燃烧时有黄色火焰,产生有毒和刺激性的氮氧化物气体,对皮肤有刺激作用。人经口大量摄入能产生肠胃炎、腹痛、呕吐、心律不齐、脉搏不匀等症状,严重者痉挛而至死亡。人的致死量LD为15.3g。眼睛和皮肤接触硝酸钠后,应以大量水冲洗。
5.急性毒性[7] LD50:1267mg/kg(大鼠经口)
6.致突变性[8] 微生物致突变:其他微生物1000ppm。微核实验:仓鼠经口250mg/kg。程序外DNA合成:人Hela细胞6mmol/L。细胞遗传学分析:仓鼠肺脏5700mg/L。
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
4.其他有害作用[9] 该物质对环境有危害,应特别注意对水体的污染。
分子结构数据
1、摩尔折射率:无可用
2、摩尔体积(cm3/mol):无可用
3、等张比容(90.2K):无可用
4、表面张力(dyne/cm):无可用
5、极化率:无可用
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:3
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积62.9
7.重原子数量:5
8.表面电荷:0
9.复杂度:18.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.当含有极少量氯化钠杂质时,其潮解性大为增加。在380 ℃时开始分解,400~600 ℃时放出氮气和氧气,加热至700 ℃时放出一氧化氮,至775~865 ℃时才有少量二氧化氮和一氧化二氮产生。为氧化剂,与有机物、硫黄等接触会燃烧和爆炸。
2.稳定性[10] 稳定
3.禁配物[11] 强还原剂、活性金属粉末、强酸、易燃或可燃物、铝
4.避免接触的条件[12] 受热
5.聚合危害[13] 不聚合
6.分解产物[14] 氮氧化物
贮存方法
储存注意事项[15] 储存于阴凉、通风的库房。远离火种、热源。库温不超过30℃,相对湿度不超过80%。应与还原剂、活性金属粉末、酸类、易(可)燃物等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
合成方法
1.吸收法 用相对密度为1.24~1.30的纯碱溶液吸收硝酸盐或硝酸生产中排出的含有0.5%~1.5%NO和NO2混合气的尾气,中和液中NaNO3/NaNO2的含量可用尾气中N02/NO的比例来控制。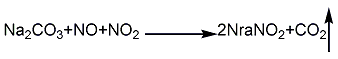

同时在中和液中加入硝酸,将NaNO2转化为NaNO3: 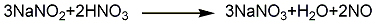
转化后的中和液用纯碱溶液中和至游离碱在0.3g/L以下,在132℃时吸收液蒸发浓缩,然后冷至75℃结晶,经分离、干燥即得产品。
2.复分解法 在反应器中加入粉碎的工业硫酸钠、50%~52%的硝酸钙溶液和循环的硝酸钠溶液,在50~55℃下搅拌反应3~4h;然后过滤,滤液经蒸发浓缩、冷却结晶、分离、干燥得产品,母液循环使用。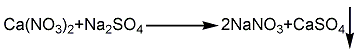
3.直接提取法 将钠硝石矿破碎至一定粒度,用淡水(或卤水)喷淋堆浸,得到一定浓度的硝酸钠卤水,经冷硝分离芒硝,把卤水送入盐田中进行日晒蒸发,待有钠硝矾(NaNO3·Na2SO4·H2O)晶体出现时,经过滤,副产氯化钠后的卤水,继续进行日晒蒸发,得到含有钠硝矾的半成品。然后将半成品用一定量的卤水(或结晶母液)加热溶解,过滤除去杂质,滤液冷却结晶,离心分离、干燥,制得硝酸钠成品。母液返回用于加热溶解半成品。
4.将48kg纯水加到200kg工业品硝酸钠中,充分搅拌2~3h,离心甩干,除去可溶性杂质,用蒸馏水细流冲洗2~3次,甩干后,每100kg晶体约加70kg热纯水,使其全部溶解,趁热过滤,滤液应澄明清亮。将滤液直接用火加热浓缩,至体积减少到原来的1/2时,即有大量结晶出现 ( 此时应多加搅拌,以免晶体粘附于盆底,受热过度而分解) 。取出晶体,离心脱水,用蒸馏水细流冲洗2~3次后再甩干,即可得化学纯级硝酸钠成品。脱水后的母液和洗液可循环处理,反复4~5次。母液可弃去,但在处理前应用5%的硝酸银溶液去除氯离子。上述方法得到的成品硝酸钠,若要使亚硝酸盐不超0.0005% ,可将成品硝酸溶解在热纯水中,按计算量加入硝酸铵,一起煮沸2h,以除去亚硝酸钠:
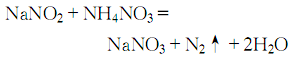
趁热过滤,滤液冷却至室温,抽滤析出的结晶,用少量纯水洗涤2~3次,甩干后即可得优级纯硝酸钠。母液和洗涤水可多次使用(10~12次),以提高产率。
5.合成方法 利用硝酸与纯碱或烧碱进行反应制取硝酸钠。反应式如下: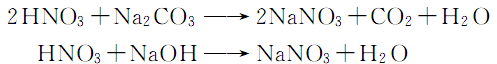
6.离子交换法 以Nacl和NH4NO3为原料,分别配成一定含量的溶液,经过精制之后,令这两种溶液先后通过离子交换树脂床,制得硝酸钠和氯化铵溶液,再分别进行浓缩、冷却结晶、离心分离、干燥、包装,得到产品硝酸钠和副产品氯化铵。利用此法生产的硝酸钠纯度高,可达试剂级水平。此外,还可利用天然智利硝石,经水淬取、过滤、浓缩、结晶等步骤后制得硝酸钠。
用途
1.是制造硝酸钾、矿山炸药、苦味酸、染料等的原料。制造染料中间体的硝化剂。玻璃工业用作生产各种玻璃及其制品的消泡剂、脱色剂、澄清剂及氧化助熔剂。搪瓷工业用作氧化剂和助熔剂,用于配制珐琅粉。机械工业用作金属清洗剂,也用于配制黑色金属发蓝剂。冶金工业用作炼钢和铝合金热处理剂。轻工业用于制造香烟的助燃剂。医药工业用作青霉素的培养基。化肥工业用作适于酸性土壤的速效肥料,特别适用于块根作物,如甜菜和萝卜等。还用作熔融烧碱的脱色剂。高纯分析试剂、光谱试剂、氧化剂,还用于染料合成及炸药和焰火的制造。
2.硝酸盐类均具有早强作用,尤其是在低温、负温时作为早强、防冻剂。也是制造硝酸钾、矿山炸药、苦味酸和染料等的原料。用于制造染料中间体的硝化剂。还用作消泡剂、氧化剂、助熔剂、清洗剂、黑色金属发蓝剂及助燃剂等。
3.用作分析试剂,如氧化剂,发射光谱分析中的样品添加剂。还用于合成染料、药物,制焰火与炸药。
4.在牙膏中用作缓蚀剂、脱敏剂,防止牙本质过敏。还可用于搪瓷、玻璃工业、染料中间体及药物、火药的制备等。
5.硝酸钠在水处理领域主要用作缓蚀剂、锅炉金属脆化的抑制剂。此外,其他领域的用途也很广。在低压锅炉系统内加入硝酸钠抑制水侧金属的腐蚀和防止金属材料脆化。硝酸钠用作金属脆化抑制剂时,需与氢氧化钠复配使用,并保持一定的比例。
6.电镀级或化学纯的硝酸钠可用于电镀黑铬的添加,还可用于镀黑铬电解液中,以及镀锌层的低铬酸钝化、浸锌、镁和镁合金的氧化溶液中。
7.用于搪瓷、玻璃业、染料业、医药、农业上用作肥料。[16]
安全信息
危险运输编码:UN1498 5.1/PG 3
危险品标志: 氧化剂
氧化剂  有害
有害
安全标识:S17 S26 S27 S36/S37/S39
文献
[1~16]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号