| 物竞编号 | 0JWY |
|---|---|
| 分子式 | NaH |
| 分子量 | 24.00 |
| 标签 | 还原剂, 缩合剂, 催化剂 |
编号系统
CAS号:7646-69-7
MDL号:MFCD00003471
EINECS号:231-587-3
RTECS号:暂无
BRN号:暂无
PubChem号:24853383
物性数据
1.性状:白色至淡灰色的细微结晶,以25%~50%比例分散在油中。[8]
2.熔点(分解,℃):800[9]
3.沸点(℃):分解[10]
4.相对密度(水=1):0.92[11]
5.溶解性:不溶于液氨、苯、二硫化碳,溶于熔融的氢氧化钠。[12]
毒理学数据
1.急性毒性 暂无资料
2.刺激性 暂无资料
生态学数据
该物质对环境可能有危害,对水体应给予特别注意。
分子结构数据
1、摩尔折射率:无可用
2、摩尔体积(cm3/mol):无可用
3、等张比容(90.2K):无可用
4、表面张力(dyne/cm):无可用
5、极化率:无可用
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:1
8.表面电荷:0
9.复杂度:0
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.氢化钠为白色至淡灰色的细微结晶,以25%-50%比例分散在油中,氢化钠制成品是一个氢化钠在矿物油中的50~80的微晶分散体。典型粒度范围为5-50微米。在800°C熔化同时分解,不溶于液氨、苯、二硫化碳、四氯化碳、熔融的氢和其它有机溶剂;在室温下的干燥空气或氧气中稳定,在潮湿空气中极易水解;遇水剧烈反应。在400~430℃时分解产生H2。在加压下的熔点为800℃以上。在水中分解并产生氢气而溶解,反应激烈而放热,甚至起火,因而在空气中处理氢化钠是很危险的。如果有痕量钠存在时,即使在低温下也可以起火。当作为还原剂使用时,应将其制成氢化钠的悬浮液(在油中)。
2.试剂的矿物油分散物是固体,可以在空气中取用。分散物和戊烷混合搅拌可以从中除去矿物油,氢化物下沉,用吸液管吸去浮在表面上的戊烷/矿物油,但是在吸取前应用少量的乙醇处理上层清液,以避免氢化物被吸走。干燥的固体应保存在惰性气体中。
3.氢化钠粉粒是剧烈的刺激物,因此,所有的操作都应在干燥的环境和通风橱中进行。氢化钠在温度低于230 oC的干燥空气中是稳定的,到230 oC时燃烧。在潮湿的空气中,氢化钠迅速分解,如果是纯的粉末,水解产生的热量能导致自燃。氢化钠比金属钠更容易与水反应,反应产生的热量可使氢气燃烧。
4.稳定性[13] 不稳定
5.禁配物[14] 酸类、醇类、水、二氧化碳、强氧化剂、氧、卤素
6.避免接触的条件[15] 受热、潮湿空气
7.聚合危害[16] 不聚合
贮存方法
储存注意事项[17] 储存于阴凉、干燥、通风良好的专用库房内,远离火种、热源。库温不超过32℃,相对湿度不超过75%。包装密封。应与氧化剂、酸类、醇类、卤素等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有合适的材料收容泄漏物。
合成方法
工业上是把金属钠分散在矿物油中,使高压氢与之反应以制取氢化钠。
步骤1:金属钠悬浮液的制备。
实验装置如图Ⅰ12所示。
反应容器为容量1L的硬质玻璃三口烧瓶。中间的口安装油封搅拌器;另一口安装冷凝管,连有干燥管,并与出气导气管相连,导气管插入石蜡油中;第三口插一温度计和一个三通旋塞的进气管,用于切换氮气和氢气的通入。往反应烧瓶中加入100g溶有0.25g油酸的洁净矿物油(沸点为300℃以上者),转动三通旋塞通入氮气,赶走反应器中的空气,保证气路畅通。取下冷凝管,从该口加入反应所需的小块金属钠或钠丝(已去除表面的氧化层)。装钠完毕迅速将冷凝管装好,将烧瓶加热至105℃,使金属钠熔化。开启搅拌,逐渐加速,1~2min以后达到最高速度,保持烧瓶温度在105~125℃之间,搅拌约15min,这样得到灰白色的金属钠悬浮液。
步骤2:氢化钠的制备
往上述烧瓶中继续通氮气,搅拌并加热,当溶液温度升到220℃时,加速搅拌,同时将氮气切换成氢气,以0.2L/min的流速通入,继续升温,温度保持在280~380℃之间,氢气被迅速吸收,逸出的氢气流量很小,石蜡油中出现的气泡很少。反应接近完成时,气泡量逐渐增多。反应完成需1~2h。停止加热,继续通入少量氢气,自然降温至100℃,将氢气换成氮气,直至冷却至室温。
氢化完毕将烧瓶中的物料转移至烧杯中,加入等量的己烷,充分搅拌,即有氢化钠结晶沉淀下来,抽滤。在滤液中再加入己烷,如有氢化钠沉淀,再抽滤,将沉淀合并。将滤液重复操作几次,直至无沉淀产生。最后用干燥的氮气吹干沉淀上附着的己烷。干燥的NaH反应性强,易燃,应保存在充有氮气的密闭的容器中。
用途
1.在有机合成中用作还原剂、缩合剂、烷基化试剂、氢化催化剂、克莱逊氏试剂,用作释氢剂。
2.氢化钠 (NaH) 参与多种反应,在反应中是强碱,能与氧、氮、碳和锗/硅有机酸反应,或者与其它化合物组成催化剂。氢化钠还是一种还原剂和溶剂干燥剂。
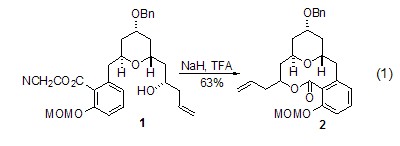
与O-有机酸反应 氢化钠可以促进分子内的酯交换反应。Su等人在全合成(–)- Apicularen A 时,在稀释的四氢呋喃中,化合物1与氢化钠回流,酯交换反应后得到大环内酯类化合物2 (式1)[1]。
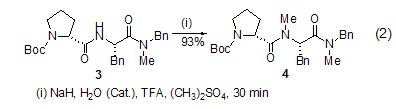
与N-有机酸反应 氨基酸及其衍生物的N-甲基化试剂通常采用CH3I,在NaH和催化量的水存在下,在TFA中,化合物3与(CH3)2SO4反应 (30 min) 得到化合物4 (式2)[2]。氢化钠与催化量的水反应生成高活性的氢氧化钠,从而使反应速率加快,收率提高。一分钟内反应基本完成,比直接用粉末状的氢氧化钠快得多。此方法不失为氨基酸及其类似物甲基化的有效方法。
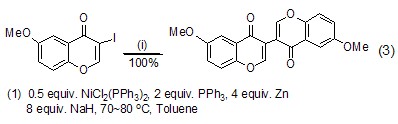
与C-有机酸反应 在Ullmann偶合反应中,氢化钠作为强碱与 NiCl2(PPh3)2、PPh3、Zn、甲苯组成的催化系统,反应产率和ee值均很高 (式3)[3]。用氢化钠脱卤化氢是形成亚甲基的很好方法[4]。
与Ge/Si-有机酸反应 在醚溶剂中,Ge-H键和Si-H键可以被氢化钠切断[5]。高温下,氢化钠还可以把Si-O键转变成Si-C键 (式4)[6],这是把Si-O键转变成Si-C键的一种方便、快捷的方法。
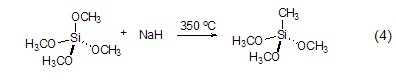
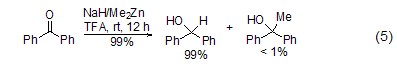
作为还原剂 NaH和Me2Zn组成的还原剂复合物可以把酯、氨基化合物、醛、酮还原成相应的醇、胺,还可以高选择性地对α,β-不饱和羰基化合物进行1,2-还原,使环氧化合物立体选择性开环。在酮存在时,化学选择性地还原醛。在还原剂复合物中,氢化钠作为Lewis碱,Me2Zn作为Lewis酸,二者在溶剂TFA 中形成复合物。此还原剂复合物的选择性很好 (式5),是一种很好的将醛、酮还原成醇的方法[7]。
3.用作缩合剂、烷化剂及还原剂等。[18]
安全信息
危险运输编码:UN 1427 4.3/PG 1
危险品标志: 易燃
易燃
危险标识:R15
文献
1. Su, Q. B.; Panek, J. S. J. Am. Chem. Soc., 2004, 126, 2425. 2. Prashad, M.; Har D.; Hu, B.; Kim, H. Y.; Repic, O.; Blacklock, T. J. Org. Lett., 2003, 5, 125. 3. Lin, G. Q.; Hong, R. J. Org. Chem., 2001, 66, 2877. 4. Khan, K. M.; Perveen, S.; Shah, S. T. A.; Shekhani, M. S.; Voelter, W. New J. Chem., 2001, 25, 896. 5. Corriu, R. J. P.; Guerin, C. J. Organomet. Chem., 1980, 197, 19. 6. Schattenmann, F. J.; Ligon, W. V.; Donahue, P.; Grade, H.; Abatto, K. Organometallics, 2004, 23, 6202. 7. Uchiyama, M.; Furumoto, S.; Saito, M.; Kondo, Y.; Sakamoto, T. J. Am. Chem. Soc., 1997, 119, 11425. [1~7]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [8~18]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号