| 物竞编号 | 112J |
|---|---|
| 分子式 | C2H4O3 |
| 分子量 | 76.05 |
| 标签 | 过氧乙酸, 过醋酸, 过氧化醋酸, 过氧化乙酸, 过乙酸, 乙酰过氧化氢, 过氧醋酸, Peracetic acid, Peroxyacetic acid, 漂白剂, 氧化剂, 酸类溶剂 |
编号系统
CAS号:79-21-0
MDL号:MFCD00002128
EINECS号:201-186-8
RTECS号:SD8750000
BRN号:1098464
PubChem号:暂无
物性数据
1.性状:无色液体,有强烈刺激性气味。[14]
2.pH值:<1.5[15]
3.熔点(℃):0.1[16]
4.沸点(℃):105[17]
5.相对密度(水=1):1.15(20℃)[18]
6.相对蒸气密度(空气=1):2.6[19]
7.饱和蒸气压(kPa):2.6(20℃)[20]
8.临界压力(MPa):6.4[21]
9.辛醇/水分配系数:-1.07[22]
10.闪点(℃):40.5(OC)[23]
11.引燃温度(℃):200[24]
12.溶解性:溶于水,溶于乙醇、乙醚、硫酸。[25]
毒理学数据
1、皮肤/眼睛刺激性
开放的刺激试验:兔子,皮肤接触:500mg,反应的严重程度:严重。
标准的Draize试验:兔子,眼睛接触:1mg;反应的严重程度:严重。
2、急性毒性:
大鼠经口LD50:1540μL/kg;大鼠经吸入LC50:450mg/m3;小鼠经口LC50:210mg/kg;小鼠经静脉LC50:17860μg/kg;兔子经皮肤接触LD50:1410μL/kg;豚鼠经口LD50:10mg/kg;
3、慢性毒性/致癌性 小鼠经皮肤接触TCLo:21mg/kg/26W-I;
4.急性毒性[26]
LD50:1540μl(1771mg)/kg(大鼠经口);1410μl(1622mg)/kg(兔经皮)
LC50:450mg/m3(大鼠吸入)
5.刺激性[27] 家兔经眼:1mg,重度刺激。
6.致突变性[28] DNA损伤:鱼多种途径0.61mg/L(连续20d)
生态学数据
1.生态毒性 暂无资料
2.生物降解性[29]
好氧生物降解(h):24~168
厌氧生物降解(h):96~672
3.非生物降解性[30]
水中光氧化半衰期(h):4~198
空气中光氧化半衰期(h):13.8~138
分子结构数据
1、摩尔折射率:14.62
2、摩尔体积(cm3/mol):62.5
3、等张比容(90.2K):153.1
4、表面张力(dyne/cm):36.0
5、介电常数:无可用的
6、极化率:5.79
7、单一同位素质量:76.016044 Da
8、标称质量:76 Da
9、平均质量:76.0514 Da
计算化学数据
1.疏水参数计算参考值(XlogP):-0.4
2.氢键供体数量:1
3.氢键受体数量:3
4.可旋转化学键数量:1
5.互变异构体数量:无
6.拓扑分子极性表面积46.5
7.重原子数量:5
8.表面电荷:0
9.复杂度:40.2
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.具有弱酸性,易挥发,有强烈刺激性气味,并带有很强的乙酸气味。对纸、木塞、橡胶和皮肤等有腐蚀作用。过氧乙酸是爆炸性物质,但是当在有机溶剂中浓度小于55%时,室温下操作是安全的。该试剂应该在通风橱中使用。使用时有必要准备一个安全护罩。
2.稳定性[31] 不稳定
3.禁配物[32] 强还原剂、强碱、金属盐类
4.避免接触的条件[33] 受热、光照、震动
5.聚合危害[34] 不聚合
6.分解产物[35] 氧气
贮存方法
1.储存注意事项[36] 储存于有冷藏装置、通风良好、散热良好的不燃结构的库房内。远离火种、热源。库温不超过30℃,相对湿度不超过80%。避免光照。保持容器密封。应与还原剂、碱类、金属盐类分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。禁止震动、撞击和摩擦。
2.用聚乙烯听外用木箱包装。贮存于阴凉、通风良好的不燃材料结构的低温库房。避免受热,防止阳光直射。与其他物品及金属隔离贮运。严防产生电火花等情况。大量储存须装置自动喷水设施。
合成方法
1.由乙酸与双氧水反应而得。
2.由乙醛直接氧化制得。在不锈钢反应釜中,以乙酸钴、酒石酸盐作催化剂,以丙酮或乙酸乙酯作为溶剂,将空气直接通入乙醛溶液中氧化生成过氧乙酸,反应温度控制在65~100℃,空气压力为1.47MPa。
3.在硫酸作用下,由乙酸和过氧化氢反应制得。或者以乙酸钴、酒石酸盐作催化剂,以丙酮或乙酸乙酯作为溶剂,在一定温度和压力下将空气直接通入乙醛溶液中氧化生成过氧乙酸。
4.过氧化氢法 在硫酸作用下,由乙酸和过氧化氢反应,用质量分数4%的磷酸或8-羟基喹啉作稳定剂。其反应式为:
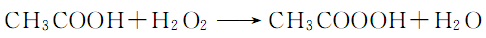
将冰乙酸与2/3的双氧水混合,搅拌30min后,再加入剩余的双氧水和浓硫酸,继续搅拌反应3h,加入少量8-羟基喹啉或磷酸,搅拌后放置72h即得。
5.制法:
各种浓度的过氧乙酸,可由30%的双氧水(1份)与冰醋酸(3份)在催化量的硫酸存在下进行反应,而后用醋酸稀释。过氧乙酸的浓度可用碘量滴定法来测定(见过氧苯甲酸)。使用时有时需要除去其中的硫酸,方法是加入计量的醋酸钠。中和后的过氧乙酸不能久置,应理解使用。[38]
6.制法:
于装有搅拌器、温度计、滴液漏斗的反应瓶中,加入30%的过氧化氢100g,于40℃以下慢慢滴加醋酸酐450g,加完后于40℃搅拌反应4h。室温放置过夜,得浓度约1mol/L的过氧乙酸溶液。于5℃放置数周其浓度不显著下降。[39]
用途
1.主要用作纸张、石蜡、木材、织物、油脂、淀粉的漂白剂。医药工业用作饮水、食品和防止传染病的消毒剂。有机工业用作制造环氧丙烷、甘油、己内酰胺的氧化剂和环氧化剂。塑料工业用于制造环氧树脂和增塑剂。分析化学中用作化学试剂。此外,还可用作防腐剂等。
2.是一种绿色生态杀菌剂,在环境中没有任何残留。与冷却水中一些常用的阻垢缓蚀剂,具有很好的相容性。杀菌能力强,既可用作循环冷却水和油田回注水处理的杀菌剂,也可用于传染病的消毒、饮用水消毒、织物消毒和食品工业等。是一种非常有推广前途的杀菌剂,其性能优于戊二醛和异噻唑啉酮。过氧乙酸还用作纺织、纸张、油脂、石蜡和淀粉的漂白剂。在有机合成中作为氧化和环氧化剂,用于环氧丙烷、甘油、己内酰胺的合成中。
3.强氧化剂。用于烯羟的环氧化,芳稠环的氧化,吡啶的N一氧化和甾体C5和C14位的氧化,还氧化脐成氧化偶氮化合物,碘苯成亚碘酰苯,酚成醌,硫醚成亚砜和砜等。
4.过氧乙酸是一种常见的氧化剂。它可以氧化简单烯烃,含有不同官能团(比如醚,醇,酯,酮和氨基等)的烯烃,一些芳香化合物,呋喃,硫化物,胺等。它还可以在催化剂存在下氧化烯烃。
烯烃的环氧化 在工业上,为了避免使用大量该试剂可能出现的危险,一般会原位制备它,以这种方式制备的过氧乙酸被广泛用来进行植物油和脂肪酸的环氧化。在搅拌条件下,在50 oC左右的含有催化剂量硫酸(质量分数1%)的乙酸溶液的底物中逐渐加入50% 的H2O2,溶液中H2O2的浓度应保持同一数值,不再增大。过氧乙酸边生成边消耗 (式1)。H2O2一般2 h滴完,反应温度也增大并保持在60 oC左右直到所有的H2O2消耗完 (大约3 h)。反应溶液用水稀释,分离出不溶于水的环氧化物。由于催化剂硫酸对于过氧乙酸的快速形成是必需的,所以这种原位方法只适用于制备能在酸催化剂存在下稳定存在的环氧化物。如果反应完成的温度和时间控制恰当,则能够以很好的产率得到脂肪酸的环氧化物。
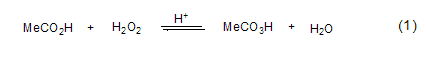
对于烯烃的环氧化反应而言,过氧乙酸的乙酸乙酯溶液是比乙酸溶液更好的反应试剂,这主要是因为大量的乙酸在后续反应中容易导致环氧化物开环。
由于双键上电子云密度低,端烯通过过氧乙酸环氧化的反应一般进行较缓慢。而用一些特殊的金属配合物则能完成缺电子结构烯烃的环氧化[1]。以三价铁离子螯合物{[(phen)2-(H2O)FeIII]2(μ-O)}(ClO4)4为催化剂,过氧乙酸在0 oC下,5分钟内就能以很高的产率氧化端烯而得到环氧化产物 (式2)。大多数烯烃都可以用于这个反应[2]。这个反应的活性与溶液的pH值有关,当pH ≤ 2时反应活性最好。二价锰离子配合物[MnII(R,R-mcp)(CF3SO3)2]也有类似的活性[3]。
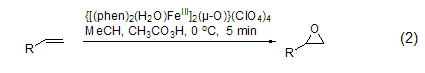
易分解的丙烯基环氧化物可以通过反应式3所示方法制备[4]。这个方法已经成功地用来从1,3-环戊二烯[5]、1,3-庚二烯和1,3-辛二烯制备丙烯基环氧化物。
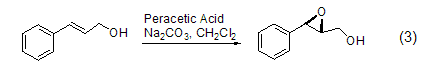
环氧化反应具有区域选择性和立体选择性,总是优先在电子云密度大的烯键上发生 (式4)[6]。二烯的环氧化具有区域选择性和立体选择性,反应位点是在较多取代的双键位阻较小的一侧。
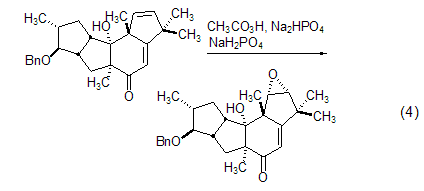
呋喃的氧化 2,5-二取代呋喃可以通过过氧乙酸氧化断裂;苯并呋喃可以被过氧乙酸氧化为内酯 (式5)[7,8]。
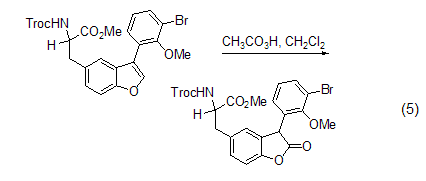
芳香化合物的氧化 某些取代芳香化合物可以被过氧乙酸有效地氧化为醌。如在Mn(III) 或者Fe(II) 的配合物催化下,萘和甲基萘被过氧乙酸氧化而得到萘醌 (式6)[9]。
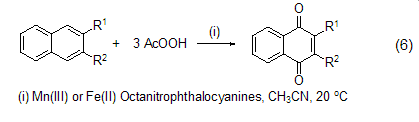
钌、锇催化氧化 在三氯化钌催化剂存在下,烯烃与过氧乙酸反应生成α-酮醇。这个反应必须在两相体系中进行。共轭双烯,烯丙基叠氮化物,α,β-不饱和酯 (式7)[9] 都可以被这种试剂氧化。
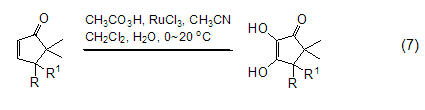
其它应用 近年来,过氧乙酸还衍生出一些新的用途,如:将硫醚氧化为亚砜[10];烷硫基氧化为烷基亚磺酰基[11]。氧化氮杂环,如把吡啶氧化为N-氧化胺[12]。把硅烷氧化为羟基 (式8)[13]。
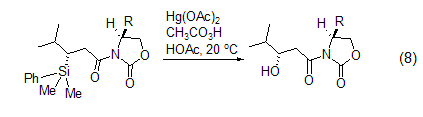
5.用作漂白剂、催化剂、氧化剂及环氧化剂,也用作消毒剂和杀菌剂。[37]
安全信息
危险运输编码:UN 3109 5.2/PG 2
危险品标志: 氧化剂
氧化剂  腐蚀
腐蚀  危害环境
危害环境
安全标识:S3 S7 S9 S14 S23 S26 S60 S61 S36/S37/S39
危险标识:R7 R10 R20 R22 R34 R35 R50 R20/21/22
文献
[1~13]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [14~37]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8 [38][39]参考文献:樊能廷•有机合成事典•北京:北京理工大学出版社,1992:658. 参考书:有机化合物合成手册/孙昌俊,王秀菊,孙风云主编. 北京:化学工业出版社,2011.8 ISBN 978-122-11519-5
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号