| 物竞编号 | 0DMY |
|---|---|
| 分子式 | (CH3)3SiN3 |
| 分子量 | 115.21 |
| 标签 | 三甲基硅叠, Azidotrimethylsilane, TMSA, TMSN3 |
编号系统
CAS号:4648-54-8
MDL号:MFCD00001986
EINECS号:225-078-5
RTECS号:暂无
BRN号:1903730
PubChem号:24849336
物性数据
1. 性状:无色液体
2. 密度:0.88
3. 熔点(ºC):不确定
4. 沸点(ºC):97
5. 闪点(ºC):不确定
6. 溶解性:溶于大多数有机溶剂,通常在CH2Cl2、THF和MeCN 中使用。
毒理学数据
主要的刺激性影响
在皮肤上面:可能引起发炎
在眼睛上面:可能引起发炎
致敏作用:没有已知的敏化影响
生态学数据
通常对水是不危害的,若无政府许可,勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:1
5.互变异构体数量:无
6.拓扑分子极性表面积14.4
7.重原子数量:7
8.表面电荷:0
9.复杂度:97.2
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:1
15.共价键单元数量:1
性质与稳定性
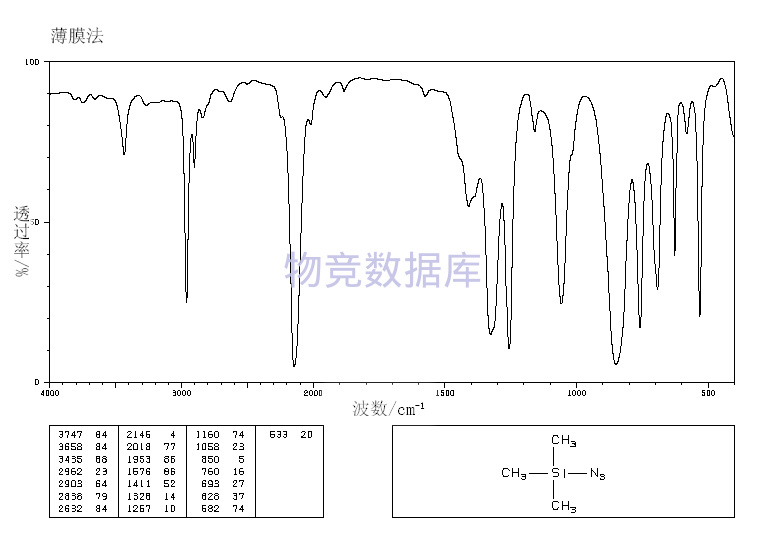
1.常温常压下稳定, 无色液体。熔点-95℃,沸点95℃(96kPa),52-53℃(23.3kPa),相对密度0.87(20/4℃),折光率1.4140(20℃).
2.对湿气敏感,在500 oC会发生分解。建议在干燥阴凉处保存,在通风橱中操作和使用。
贮存方法
常温,避光,通风干燥处,密封保存。
合成方法
1.通过三甲基氯硅烷与叠氮化钠反应来制备[1]。
2.注意!此反应应在通风橱中安全屏后面进行。如果反应系统不是绝对于燥,存在毒性的叠氮酸是可能的。
方法一:在1升三颈烧瓶上安装搅拌器、带千燥管的回流冷凝器和恒压漏斗。先在烘箱中干燥,然后趁热装k: i..}好,立即用千燥氮气清扫,氮气可以方便地从加料的漏斗顶上通入。之后在瓶中盛81克( 1.25摩尔)叠氮化钠500毫升所蒸的二甘醇二甲醚。在烘箱巾干燥一套简单蒸馏仪器,趁热用慢速氮气流清扫。蒸馏瓶中盛112克只甲其氧硅烷。在蒸出大约2克初馏分之后,把其余的物料直接蒸馏.反应瓶的加料漏斗中。蒸馏时很方便地把氮气Y从加料漏斗顶部却下而接入蒸馏瓶中。蒸馏完后,拆去蒸馏仪器,把氮气再接到加料漏斗顶上。然后把108.6克(1.0摩尔)三甲基氧硅烷迅速地加到叠氮化钠浆中,此混合物在70℃搅拌的60小时,此时,氮气流可以停止。加热完成,再次通氮,将混合物冷至30℃。把加料漏斗和回流冷凝器换成两支带玻璃寒的气体导入管,一支连接氮气原,另一支则连接到标准真空阱,其容量至少150毫升。15-20毫米的真空原连接冷却至一78℃的阱。然后把产物在30C芯馏到阱中,须稍稍加热以保持30℃。在吸收操作蔡个过程中,应连续快速搅拌。在此条件下5小时内蒸完挥发性物。用氮气使整个系统慢慢恢复到常压,产物经过5厘米松针形分馏柱重蒸馏。从总量121克的粗闪蒸液得到}i}克初馏液和98克(85%)的纯叠氮三甲硅烷,沸点95-99℃。蒸馏时,用但温油浴把釜温保持在135一140℃。釜底残余物含19克二甘醇二甲醚和微最叠氮三甲硅烷。核磁共振谱(四氯化碳)测定产物的纯度为98%.

方法二:布烘于的500毫升三颈烧瓶中,盛71.5克(1.1摩尔)叠氮化钠和150毫升HMPT。在搅拌下1小时内加入108.6克(1.0摩尔)三甲基氯硅烷,加入的速度以反应浆状物的红橙色不消失为准。加完后,把滴液漏斗换成部分回流蒸馏头,收集沸点 90一102℃的馏分,为浊状液体。将釜底残余物过滤,滤液可重用作下次制备的溶剂。浊液经过30厘米Widmer分馏柱蒸馏而精制。
用途
1.用于有机合成。用作中间体。
2.合成氮杂环。从酰氯制异氰酸酯。叠氮酸的代用试剂。
3.叠氮基三甲基硅烷 (TMSA) 是有机合成中应用非常广泛的试剂之一。它可以看作是金属叠氮化物的替代物,几乎能够发生金属叠氮化物的所有反应。但是,TMSA能够在许多有机溶剂中反应,所以更容易操作和获得较好的结果。该试剂的反应性质来自于分子的两个组成部分,以叠氮基所发生的反应具有较高的合成价值。
TMSA可以方便地与卤代烃或者磺酸酯发生反应,生成相应的叠氮化合物 (式1)[2,3]。反应也可以在无催化剂存在的情况下进行,但一般需要较高的反应温度。
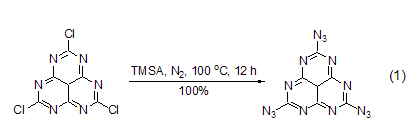
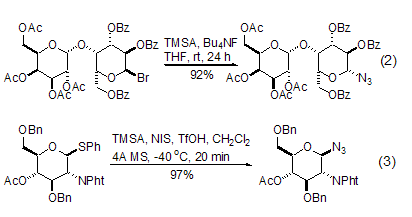
TMSA与那些容易生成碳正离子的缩醛衍生物的反应具有较高的合成价值,特别是在糖化学转变中,用该方法可以方便地得到糖的叠氮化合物。卤代缩醛或者硫代缩醛具有较高的反应活性 (式2,式3)[4,5],半缩醛或者半缩醛的羧酸酯可以在反应中原位转化成为离去能力较强的官能团后再进行叠氮化反应[6,7]。
TMSA可以在金属催化剂的作用下与环氧化合物发生开环反应,生成1(2)-羟基-2(1)-叠氮化合物。该产物进一步被还原就得到1(2)-羟基-2(1)氨基化合物,所以具有重要的合成价值。选择适当的催化剂,该反应可以显示出高度的立体选择性 (式4)[8]。如果使用手性催化剂,可以实现高度的对映体选择性[9]。
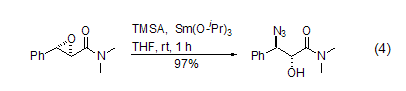
由于TMSA中的叠氮基具有1,3-偶极结构,所以很容易与缺电子炔烃发生[3+2]成环反应,生成三氮唑的衍生物 (式5)[10]。文献报道,使用CuI为催化剂可以提高炔烃的反应活性[11]。如果反应底物为氰基的话,则生成四氮唑的衍生物[12~14]。该反应需要催化剂的存在下才能进行,许多路易斯酸金属催化剂可以用于该目的。有时金属叠氮化物不能够进行的反应,TMSA 可能会给出很好的结果 (式6)[12]。

安全信息
危险运输编码:UN 1992 3/PG 2
危险品标志: 易燃
易燃  有毒
有毒
安全标识:S16 S45 S36/S37/S39
文献
1. Nishiyama, K.; Yamaguchi, T. Synthesis, 1988, 106. 2. Lu, J.; Jayaprakash, K. N.; Schlueter, U.; Fraser-Reid, B. J. Am. Chem. Soc., 2004, 126, 7540. 3. Miller, D. R.; Swenson, D. C.; Gillan, E. G. J. Am. Chem. Soc., 2004, 126, 5372. 4. Ohlsson, J.; Larsson, A.; Haataja, S.; Alajaeaeski, J.; Stenlund, P.; Pinkner, J. S.; et al. Org. Biomol. Chem., 2005, 3, 886. 5. Pratt, M. R.; Bertozzi, C. R. J. Am. Chem. Soc., 2003, 125, 6149. 6. Bodine, K. D.; Gin, D. Y.; Gin, M. S. J. Am. Chem. Soc., 2004, 126, 1638. 7. Trost, B. M.; Yang, H.; Probst, G. D. J. Am. Chem. Soc., 2004, 126, 48. 8. Tosaki, S.-y.; Tsuji, R.; Ohshima, T.; Shibasaki, M. J. Am. Chem. Soc., 2005, 127, 2147. 9. Martinez, Luis E.; Leighton, James L.; Carsten, Douglas H.; Jacobsen, Eric N. J. Am. Chem. Soc., 1995, 117, 5897. 10. Roppe, J.; Smith, N. D.; Huang, D.; Tehrani, L.; Wang, B.; Anderson, J.; Brodkin, J. et al. J. Med. Chem., 2004, 47, 4645. 11. Jin, T.; Kamijo, S.; Yamamoto, Y. Eur. J. Org. Chem., 2004, 3789. 12. Terinek, M.; Vasella, A. Helv. Chim. Acta, 2003, 86, 3482. 13. Amantini, D.; Beleggia, R.; Fringuelli, F.; Pizzo, F.; Vaccaro, L. J. Org. Chem., 2004, 69, 2896. 14. Schulz, M. J.; Coats, S. J.; Hlasta, D. J. Org. Lett., 2004, 6, 3265. 15.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号