| 物竞编号 | 172M |
|---|---|
| 分子式 | SO2 |
| 分子量 | 64.06 |
| 标签 | 亚硫酸酐, 无水亚硫酸, 纯亚硫酸酐, Sulfurous anhydride, Sulfurous oxide, Sulfurous anhydride, 还原性漂白剂, 冷冻剂, 防腐剂, 熏蒸剂, 杀虫剂, 杀菌剂, 电子特种气体原料及中间体 |
编号系统
CAS号:7446-09-5
MDL号:MFCD00011450
EINECS号:231-195-2
RTECS号:WS4550000
BRN号:3535237
PubChem号:暂无
物性数据
1.性状:无色气体,有刺激性气味。[1]
2.熔点(℃):-75.5[2]
3.沸点(℃):-10[3]
4.相对密度(水=1):1.4(-10℃)[4]
5.相对蒸气密度(空气=1):2.25[5]
6.饱和蒸气压(kPa):330(20℃)[6]
7.临界温度(℃):157.8[7]
8.临界压力(MPa):7.87[8]
9.辛醇/水分配系数:-2.20[9]
10.溶解性:溶于水、乙醇、乙醚。[10]
11.黏度(mPa·s,0ºC):0.3936
12.黏度(mPa·s,-10.5ºC):0.4285
13.黏度(mPa·s,-15ºC):0.4521
14.黏度(mPa·s,-33.5ºC):0.5508
15.蒸气压(kPa,-268C):338.42
16.蒸气压(mmHg,21ºC):1779
17.蒸发热(KJ/mol,-10.08ºC):24.95
18.熔化热(KJ/mol):7.41
19.生成热(KJ/mol,25ºC):297.01
20.沸点上升常数:1.48
21.电导率(S/m):3×10-8
毒理学数据
1、大鼠吸入(1h)LC50:6600mg/m3。ADI 0~70mg/kg(以SO2计,包括SO2和亚硫酸盐的总ADI;FAO/WHO,2001)。对眼及呼吸道黏膜有强烈的刺激作用。SO2在空气中浓度达0.04%~0.05%时,人就会中毒。
2、属中等毒类,易被湿润的黏膜表面吸收而生成亚硫酸,其中部分氧化为硫酸,故对呼吸道和眼有强烈的刺激作用。轻度中毒时发生流泪、畏光、咳嗽、鼻、咽、喉部灼烧样痛、声音嘶哑,甚至呼吸短促、胸闷、胸痛。有时还会出现恶心、呕吐、上腹痛、头痛、头昏、全身无力等症状。严重中毒时于数小时内发生肺水肿、呼吸困难、紫绀、支气管痉挛而引起急性肺气肿。空气中的浓度为7.86~13.1mg/m3时人可感觉到,52.4mg/m3时刺激眼黏膜,1048~1310mg/m3时短时间即有生命危险。最高容许浓度为20mg/m3。
3.急性毒性[11] LC50:6600mg/m3;2520ppm(大鼠吸入,1h)
4.刺激性[12] 家兔经眼:6ppm(4h),共32d,轻度刺激。
5.亚急性与慢性毒性[13] 小鼠吸入本品5.24mg/m3,半年,出现免疫反应受抑制。
6.致突变性[14] DNA损伤:人淋巴细胞5700ppb。DNA抑制:人淋巴细胞5700ppb。细胞遗传学分析和姐妹染色单体交换:人多种接触途径42mg/m3。
7.致畸性[15] 兔孕后6~18d吸入最低中毒剂量(TCLo)70ppm(7h),致肌肉骨骼系统发育畸形。
8.其他[16] 大鼠吸入最低中毒浓度(TCLo):4mg/m3,(24h)(交配前72d),引起发情周期改变或失调,对分娩有影响,对雌性生育指数有影响。小鼠吸入最低中毒浓度(TCLo):25ppm(7h)(孕6~15d),引起胚胎毒性。
人吸入LCLo:1000ppm(10min);TCLo:3ppm(5d);400~500ppm,立即危及生命。
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
4.其他有害作用[17] 该物质可严重污染大气,由其形成的酸与对植物的危害尤为严重。
分子结构数据
1、摩尔折射率:12.05
2、摩尔体积(cm3/mol):40.2
3、等张比容(90.2K):115.1
4、表面张力(dyne/cm):66.8
5、极化率(10-24cm3):4.77
计算化学数据
1、疏水参数计算参考值(XlogP):
2、氢键供体数量:0
3、氢键受体数量:2
4、可旋转化学键数量:1
5、互变异构体数量:
6、拓扑分子极性表面积(TPSA):40.1
7、重原子数量:6
8、表面电荷:0
9、复杂度:59.8
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:2
性质与稳定性
1.在常温下,潮湿的二氧化硫与硫化氢起反应析出硫。在高温及催化剂存在的条件下,可被氢还原成为硫化氢,被一氧化碳还原成硫。强氧化剂可将二氧化硫氧化成三氧化硫,仅在催化剂存在时,氧才能使二氧化硫氧化为三氧化硫。具有自燃性,无助燃性。液态二氧化硫能溶解如胺、醚、醇、苯酚、有机酸、芳香烃等有机化合物,多数饱和烃不溶解。有一定的水溶性,与水及水蒸气作用生成有毒及腐蚀性蒸气。无机化合物如溴、三氯化硼、二硫化碳、三氯化磷、磷酰氯、氯化碘以及各种亚硫酰氯化物都可以任何比例与液态二氧化硫混合。碱金属卤化物在液态二氧化硫中的溶解度按I->Br->Cl-的次序减小。金属氧化物、硫化物、硫酸盐等多数不溶于液态二氧化硫。
2.化学性质:液态二氧化硫比较稳定,不活泼。气态二氧化硫加热到2000℃不分解。不燃烧,与空气也不组成爆炸性混合物。化学性质极其复杂,不同的温度可表现出非质子溶剂、路易氏酸、还原剂、氧化剂、氧化还原试剂等各种作用。液态二氧化硫还可作自由基接受体。如在偶氮二异丁腈自由基引发剂存在下与乙烯化合物反应得到聚砜。液态二氧化硫在光照下,可与氯和烷烃进行氯磺化反应,在氧存在下生成磺酸。液态二氧化硫在低温表现出还原作用,但在300℃以上表现出氧化作用。
3.稳定性[18] 稳定
4.禁配物[19] 强还原剂、强氧化剂、易燃或可燃物
5.避免接触的条件[20] 潮湿空气
6.聚合危害[21] 不聚合
贮存方法
储存注意事项[22] 储存于阴凉、通风的有毒气体专用库房。远离火种、热源。库温不宜超过30℃。应与易(可)燃物、氧化剂、还原剂、食用化学品分开存放,切忌混储。储区应备有泄漏应急处理设备。
合成方法
1.用氨水吸收硫酸厂尾气,吸收液含亚硫酸铵和亚硫酸氢铵,用硫酸分解可放出高浓度SO2气体,经干燥、压缩、分离和冷却即成液体产品。也可用硫黄与纯氧在焚硫炉内燃烧,生成高浓度的SO2气体,经干燥、压缩和冷凝成液体SO2。
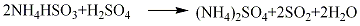
精制方法:液态二氧化硫中的杂质含有微量SO3、水、不挥发物质及空气成分(O2、N2、CO2等)。一般可直接作合成反应的溶剂使用。精制时可将液态二氧化硫气化,通入浓硫酸中以除去SO3,通入装有五氧化二磷的玻璃管或在盛有五氧化二磷的容器中进行蒸馏以除去水分。
2.氨酸法 用硫酸分解硫酸厂尾气吸收工序所得的亚硫酸铵亚硫酸氢铵母液,产生的约100%二氧化硫气体,经压缩法和冷冻法,可制得二氧化硫。
3.压缩法 用硫酸分解亚硫酸铵亚硫酸氢铵母液,分解产生的二氧化硫气体,经冷凝、干燥、过滤,再经压缩液化,制得液体二氧化硫成品。其反应式如下。
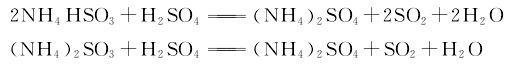
4.冷冻法 用硫酸分解亚硫酸铵亚硫酸氢铵母液,分解产生的二氧化硫气体经干燥后送至低温冷凝器,在常压下进行冷凝,用氨冷冻维持温度在液化点-10℃以下。制得液体二氧化硫成品。其反应式如下。
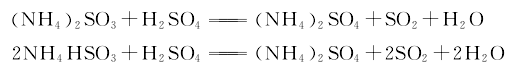
5.纯氧燃烧法 将硫磺与纯氧在焚硫炉内燃烧,生成的高浓度二氧化硫气体,经净化、干燥、压缩液化、冷凝,制得二氧化硫成品。其反应式如下。

6.柠檬酸钠法 经过净化的二氧化硫气体用柠檬酸钠溶液吸收,再用低压蒸汽脱出二氧化硫,经冷却、分离冷凝水,用浓硫酸进行干燥,然后经压缩液化、冷凝,制得液体二氧化硫成品。
用途
1.二氧化硫是我国允许使用的还原性漂白剂。对食品有漂白和对植物性食品内的氧化酶有强烈的抑制作用。我国规定可用于葡萄酒和果酒,最大使用量0.25g/kg,残留量不得超过0.05g/kg。主要用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也用作熏蒸剂、漂白剂、防腐剂、消毒剂、还原剂等。
2.主要用作硫酸的制造原料,也用作多种有机化学反应的溶剂。在液态二氧化硫中阳离子或阳碳离子与液态二氧化硫分子都能独立存在,而对阴离子的溶剂化作用强。因此液态二氧化硫作溶剂有利于阳离子作为反应中间体的化学反应,可加快反应速度。例如Beckmann重排反应,Wager Meerwein重排反应,酯化反应等。液态二氧化硫作溶剂也有利于阳离子聚合反应和顺反异构的异构化反应。此外液态二氧化硫还可用于熏蒸剂、杀虫剂、水果蔬菜防腐剂、杀菌剂、纤维漂白剂以及矿物油的精制、各种亚硫酸盐的制造、镁的冶炼等。
3.在工业中是多种化合物的良好溶剂。可用作冷冻剂、防腐剂、漂白剂及其他有机产品的原料。也用于制造保险粉和亚硫酸盐等。还用于农药、医药、人造纤维及染料等工业部门。
4.用于制造硫酸和保险粉等。[23]
安全信息
危险运输编码:UN 2037 2.3
危险品标志: 有毒
有毒
安全标识:S9 S26 S45 S36/S37/S39
文献
[1~23]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号