| 物竞编号 | 01J1 |
|---|---|
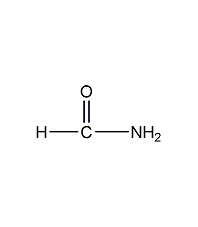
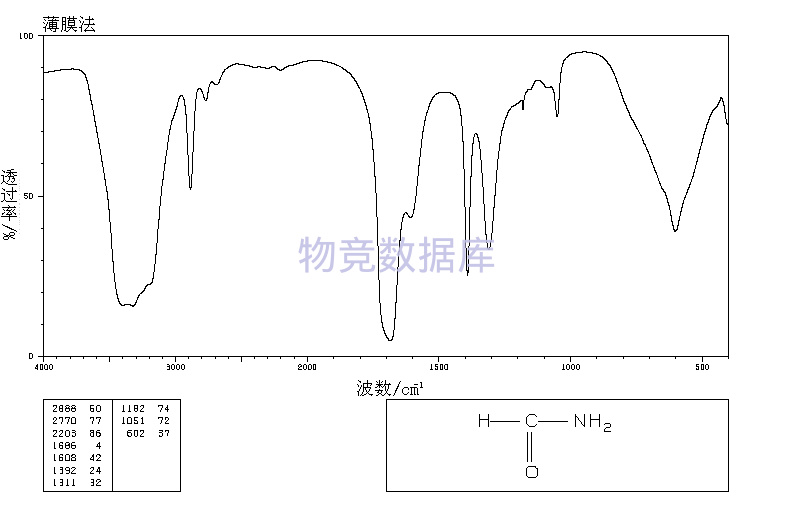
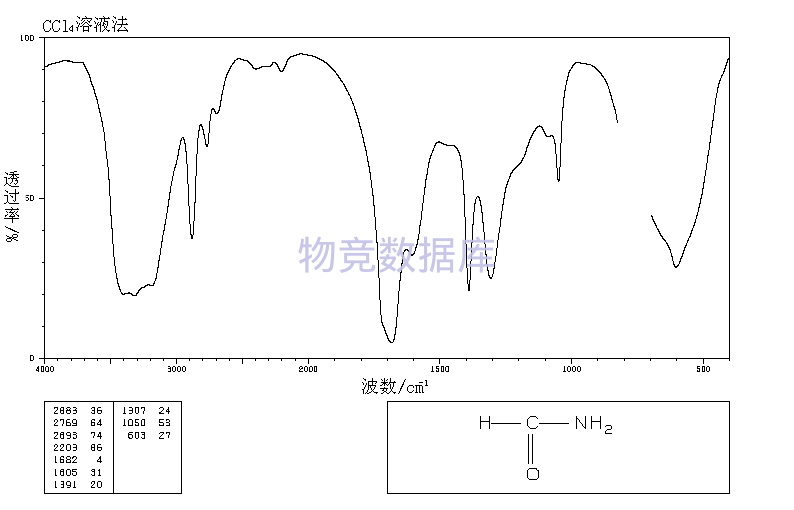
| 分子式 | CH3NO |
| 分子量 | 45.04 |
| 标签 | 氨基甲醛, Methanamide, Carbamaldehyde, 基因工程研究用试剂, 纸张的处理剂, 纤维工业的柔软剂, 动物胶的软化剂, 有机合成的反应溶剂 |
编号系统
CAS号:75-12-7
MDL号:MFCD00007941
EINECS号:200-842-0
RTECS号:LQ0525000
BRN号:505995
PubChem号:24894985
物性数据
1. 性状:无色透明的黏稠液体,略有氨味,吸湿。
2. 沸点(ºC,101.3kPa,部分分解):220, 70.5ºC(133.3pa)
3. 熔点(ºC):2.55~3
4. 相对密度(g/mL,20/4ºC):1.13339
5. 相对密度(g/mL,25/4ºC):1.134
6. 相对蒸汽密度(g/mL,空气=1):1.55
7. 折射率(20ºC):1.447
8. 折射率(25ºC):1.44682
9. 黏度(mPa·s,20ºC):3.764
10. 黏度(mPa·s,25ºC):3.302
11. 闪点(ºC,闭口):175
12. 闪点(ºC,开口):150
13. 燃点(ºC):>500
14. 蒸发热(KJ/mol,25ºC):65.021
15. 熔化热(KJ/mol):6.699
16. 生成热(KJ/mol,25ºC,液体):-254.1
17. 燃烧热(KJ/mol,25ºC,液体):568.6
18. 比热容(KJ/(kg·K),25ºC,定压):2.39
19. 电导率(S/m):<2×10-1
20. 溶解性:能与水、醇、乙二醇、丙酮、乙酸、二烷、甘油、苯酚等混溶。但几乎不溶于脂肪烃、芳香烃、醚、氯代烃、氯苯、硝基苯等。
毒理学数据
甲酰胺对皮肤、黏膜有刺激作用,偶可引起过敏,并能被皮肤吸收。大鼠经口致死量LD为7500mg/kg。大鼠经口LD50>4000mg/kg。经皮毒性豚鼠LD50<5mL/kg和LD50为2539mg/kg。
生态学数据
暂无
分子结构数据
1、 摩尔折射率:10.40
2、 摩尔体积(cm3/mol):46.0
3、 等张比容(90.2K):109.8
4、 表面张力(dyne/cm):32.4
5、 极化率(10-24cm3):4.12
计算化学数据
1、 疏水参数计算参考值(XlogP):-0.8
2、 氢键供体数量:1
3、 氢键受体数量:1
4、 可旋转化学键数量:0
5、 互变异构体数量:2
6、 拓扑分子极性表面积(TPSA):43.1
7、 重原子数量:3
8、 表面电荷:0
9、 复杂度:12.3
10、 同位素原子数量:0
11、 确定原子立构中心数量:0
12、 不确定原子立构中心数量:0
13、 确定化学键立构中心数量:0
14、 不确定化学键立构中心数量:0
15、 共价键单元数量:1
性质与稳定性
1.化学性质:甲酰胺的碱性很弱,故与强酸生成的盐非常不稳定。在水溶液中甲酰胺容易水解成甲酸铵。甲酸铵加热脱水重新变成甲酰胺:
甲酰胺的水解速度在常温下很慢,实际上是比较稳定的。但在高温特别是在酸、碱存在下水解速度比较快。甲酰胺热解有两种方式:常压下煮沸时分解成氨和一氧化碳:
在脱水剂存在下,将气态甲酰胺于400~600℃热解时,得到氰化氢,收率90%:
甲酰胺与强酸形成的加成物非常活泼可以发生下列反应:
甲酰胺在氯化氢存在下与醇反应,生成甲酸酯。与次氯酸在冷水浴中反应生成N,N-二氯甲酰胺HCONCl2,这个化合物纯净时有爆炸性。与金属钾、钠反应生成二甲酰胺(HCO)2NH的金属化合物。与烯烃发生光化学反应生成脂肪酸酰胺。与卤代烷在150℃发生反应生成甲酰胺化合物和甲酸酯:
甲酰胺与金属盐发生反应生成取代物或加合物:
甲酰胺在五氧化二磷作用下脱水生成氰化氢。
2.本品低毒。对皮肤和黏膜有暂时刺激性。小鼠经口LC50大于1000mg/kg。长期接触要穿戴好防护用品。
3. 存在于烟气中。
贮存方法
1.本品应密封阴凉干燥保存。密封保存,避免与水接触,贮存于阴凉通风处。
2.甲酰胺商品的贮运可用不锈钢制或铝制槽(槽车)或槽式容器以及60kg,220kg圆桶盛装。容器材料可用聚乙烯或衬聚乙烯的钢材。密封保存,避免与水接触,贮存于阴凉通风处。
合成方法
1.二步法 第一步由一氧化碳与甲醇在甲醇钠作用下生成甲酸甲酯。第二步甲酸甲酯再氨解生成甲酰胺,反应条件为80-100℃和0.2-0.6MPa。此法问题较少。
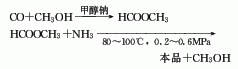
2.甲酸法甲酸与甲醇先进行酯化反应生成甲酸甲酯,然后经氨解生成甲酰胺,再进行精馏分离出甲醇和杂质后即得成品。此法由于成本高已趋向淘汰。
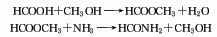
3.一步法由一氧化碳与氨在甲醇钠催化作用下,经高压(10-30MPa)和80-100℃温度直接合成甲酰胺
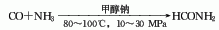
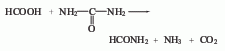
4.甲酸和尿素法。
5.新方法由甲酸钠和铵盐在一定的温度和压力下反应生成甲酰胺。此法为国内专利发明。
精制方法:甲酰胺是由一氧化碳与氨在15~20MPa、200℃的条件下大规模生产的。也可由甲酸铵加热或甲酸酯与氨反应而获得。因此常含有水、氨、甲醇、甲酸酯和甲酸铵等。使用减压分馏或分步结晶都可使甲酰胺的纯度提高。用于物理常数测定的甲酰胺可用下法精制:在甲酰胺中加入几滴溴代百里酚蓝。用氢氧化钠中和,将中和后的中性溶液于减压下80~90℃加热,再进行中和,重复操作几次,直到加热时溶液保持中性为止。然后加入甲酸钠,于80~90℃减压蒸馏。馏出物中和后再蒸馏,收集后面4/5馏分,得熔点2.2℃的甲酰胺。
6.甲酸铵加热分解后即得甲酰胺,然后再通过蒸馏精制:
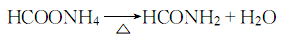
用途
1.甲酰胺具有活泼的反应性和特殊的溶解能力,可用作有机合成原料,纸张处理剂,纤维工业的柔软剂,动物胶的软化剂,还用作测定大米中氨基酸含量的分析试剂。在有机合成中,医药方面的用途居多,在农药、染料,颜料,香料,助剂方面也有很多用途。也是优良的有机溶剂,主要用于丙烯腈共聚物的纺丝和离子交换树脂中,以及塑料制品的防静电涂饰或导电涂饰等。此外,还用于分离氯硅烷、提纯油脂等。甲酰胺可发生多种反应,除了由三个氢参与反应外,还可以进行脱水,脱CO,引入氨基,引入酰基和环合等反应。举环合为例。丙二酸二乙酯与甲酰胺环合得到维生素B4的中间体4,6-二羟基嘧啶。邻氨基苯甲酸与酰胺环合得到抗心律失常经常咯啉的中间体喹唑酮-4。3-氨基-4-乙氧羰基吡唑与甲酰胺环合得到黄嘌呤氧化酶抑制剂别嘌醇。乙二胺四乙酸与甲酰胺环合得到抗癌药乙亚胺。甲氧基丙二酸甲乙酯与甲酰胺环合得到磺胺类药的中间体-5-甲氧基-4,6-二羟嘧啶二钠。
2.由于甲酰胺能溶解介电常数高的无机盐类和蛋白质,故可用于电解和电镀工业,以及用作有机合成的反应溶剂和精制溶剂。此外,甲酰胺也用作医药、染料、香料等的原料,纸张的处理剂,纤维工业的柔软剂以及动物胶的软化剂等。
3.用作有机合成原料。有机反应的极性溶剂。液相色谱的溶剂和洗脱剂。
安全信息
危险运输编码:暂无
危险品标志: 有毒
有毒
安全标识:S45 S53 S26 S36/S37/S39
文献
1. LIDE D R. Editor-in-Chief, CRC Handbook of Chemistry and Physics on CD-ROM, Version 2003, CRC Press. 2. Schmeltz I, Hoffmann D. Chem. Rev., 1977, 77: 295-311. 3. Schumacher J N, Green C R, Best F W, et al. J. Agric. Food Chem., 1977,25(2):310-320. 4. 石墨繁夫(SHIGEO ISHIGURO), 菅原志朗(SIRO SUGAWARA). The chemistry of tobacco smoke. Unpublished, 1980. 5. Johnson W R, Nedlock N W, Hale R W, 25th Tobacco Chemists'Research Conference, Program Booklet and Abstracts, Vol. 25, Paper No. 12, 1971, p. 8; Tob. Sci., 1973, 17: 89-92. 6. Johnson W R, Hale R W, Nedlock J W, Tob. Sci., 1973, 17: 73-76. 7. 参考书(烟草与烟气化学成分),谢剑平 主编, 化学工业出版社. ISBN 978-7-122-09119-2
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号