| 物竞编号 | 0BPW |
|---|---|
| 分子式 | C13H10ClN3O4S2 |
| 分子量 | 371.5 |
| 标签 | 劳诺昔康, 罗诺昔康, Chlortenoxicam,Ro-13-9297, 中枢神经系统用药 |
编号系统
CAS号:70374-39-9
MDL号:暂无
EINECS号:暂无
RTECS号:暂无
BRN号:暂无
PubChem号:暂无
物性数据
1.性状:橙色至黄色结晶
2.熔点:225~230
毒理学数据
急性毒性LD50小鼠,大鼠,兔子,狗,猴(ml/kg):全部>10口服.
生态学数据
暂无
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):2.1
2.氢键供体数量:2
3.氢键受体数量:7
4.可旋转化学键数量:2
5.互变异构体数量:8
6.拓扑分子极性表面积136
7.重原子数量:23
8.表面电荷:0
9.复杂度:634
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
暂无
贮存方法
暂无
合成方法
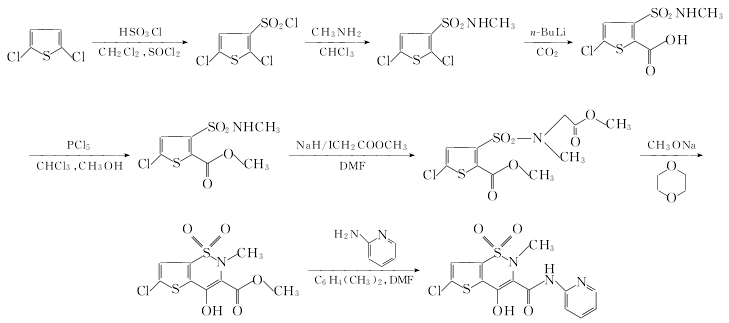
1. 2,5-二氯噻吩(Ⅰ)用氯磺酸在氯化亚砜存在下进行氯磺化反应,得到磺酰氯(Ⅱ).接着和甲胺在氯仿中酰化,得到磺酰胺(Ⅲ).再和二氧化碳及丁基锂在乙醚中进行羧化反应,得到羧酸(Ⅳ).(Ⅳ)先和五氯化磷作用,再加入甲醇,酯化得到羧酸酯(V).(V)在二甲基甲酰胺中,氢化钠存在下,和碘乙酸甲酯反应,生成叔胺(犞犐).再在甲醇钠作用下,环合得到噻嗪衍生物(Ⅶ).最后和2-氨基吡啶,在二甲苯中回流,得氯诺昔康.
2,5-二氯噻吩-3-磺酰甲胺的制备
在反应瓶中加入氯磺酸123g(1.055mol)和亚硫酰氯10g(0.084mol),在冰浴冷却下降温至5ºC,然后在搅拌下小心慢慢加入2,5-二氯噻吩(市售试剂)64.7g(0.422mol),反应混合物必须要保持<7ºC,在加料过程中有大量气体逸出,加毕,将反应液于15 ºC搅拌反应1.5h.反应液变成淡红色溶液后,将其倾入碎冰中,混合物再搅拌数分钟,则生成的磺酰氯化合物大块结晶被分散.除去过量的冰后,抽滤,用蒸馏水洗滤饼,压干,得微红色磺酰氯化合物粗品,将其溶于二氯甲烷400ml,用无水MgSO4干燥,过滤,滤液浓缩回收溶剂.剩余物再真空抽干除净溶剂,于-20 ºC下冷藏,则2,5-二氯噻吩-3-磺酰氯形成结晶磺酰氯化合物,不经进一步纯化直接用于下步反应.如将其用石油醚重结晶后25~27ºC.
在反应瓶中加入氯仿350ml和磺酰氯化合物53.3g,搅拌溶解,于20ºC搅拌下通入干燥的甲胺,直至反应液呈碱性.将反应混合物再在室温下搅拌反应1.5h,然后用0.5mol/L盐酸提取数次,有机相用无水NaSO4干燥,过滤,滤液真空浓缩,得到的油状物置于冷藏室(冰箱)低温固化结晶.所得结晶用150ml四氯化碳重结晶,过滤出的结晶于真空干燥器40ºC下干燥,得2,5-二氯噻吩-3-磺酰甲胺白色针状结晶,mp59~61ºC.
3. 5-氯-3-甲氨基磺酰噻吩-2-羧酸的制备
在反应瓶中加2,5-二氯噻吩-3-磺酰甲胺25g(0.102mol)和干燥的乙醚150ml(之前反应瓶要用干燥N2置换空气和清洗干净),在搅拌下,连续N2保护下于1h内慢慢滴加正丁基锂[16.27(0.254mol)] 的乙醚(200ml)溶液,滴毕,将反应混合物加热至沸,则有白色沉淀析出,并逐渐变成灰色,此时开始搅拌回流反应5h.冷至25ºC,向悬浮液中通入干燥的CO2气体30min,并连续搅拌.通气毕,将反应液倾入200ml水中,然后加入浓盐酸,直至其水相呈强酸性反应.水相用乙醚提取,合并全部乙醚相,用5%NaHCO3溶(30ml×3)提取.合并NaHCO3提取液相,用浓盐酸酸化至pH1~2,400ml乙醚提取.其乙醚相用无水MgSO4干燥,过滤.滤液浓缩,得淡黄色粗制品结晶,用冰醋酸重结晶得纯化的5-氯-3-甲氨基磺酰噻吩-2-羧酸.
4. 5-氯-3-甲氨基磺酰噻吩-2-羧酸甲酯的制备
在反应瓶中加入干燥的氯仿150ml和5-氯-3-甲氨基磺酰噻吩-2-羧酸9g搅拌悬浮混合,然后加入五氯化磷8.52g,将溶液加热至35 ºC,15min后其混合液变澄清,该过程必须防止高温,否则参加反应原料会发生闭环反应.共搅拌反应20~30min后,停止加热,再滴加入干燥甲醇25ml.滴毕,将反应液加热至沸,搅拌回流10min.冷却,氯仿相用少量的NaHCO3溶液洗涤数次,用水洗涤,无水Na2SO4干燥,过滤,滤液真空浓缩,研磨所得的剩余油状物,得结晶,用甲醇重结晶得5-氯-3-甲氨基磺酰噻吩-2-羧酸甲酯,mp103~104 ºC.
5. 5-氯-3-(N-甲氧基羰基亚甲基- N-甲基)氨基磺酰噻吩-2-羧酸甲酯的制备
在反应瓶中加入DMF700ml,将悬浮于矿物油中的NaH(55%)9.7g,用干燥苯洗涤后迅速加入,在N2保护下滴加5-氯-3-甲氨基磺酰噻吩-2-羧酸甲酯60g溶于干燥的DMF(525ml)溶液,控制滴加时的温度0 ºC,在1h内滴加完并连续搅拌.加毕,继续搅拌20min.于0~5 ºC2h内搅拌滴加碘乙酸甲酯44.5g溶于无水DMF(65ml)溶液.滴毕,在室温进行搅拌反应,直至反应液呈中性(用潮湿试纸检测).将反应液真空浓缩(真空度近似于133.322Pa), 剩余物加入0.5mol/L盐酸400ml和二氯甲烷400ml,充分搅拌,静置分相.水相用少量二氯甲烷提取,合并有机相,用5%NaHCO3溶液洗涤,无水Na2SO4干燥,过滤,滤液真空浓缩,得剩余物结晶,用乙醇重结晶,得5-氯-3-(N-甲氧基羰基亚甲基- N-甲基)氨基磺酰噻吩-2-羧酸甲酯50g, mp103~104 ºC.
6. 6-氯-4-羟基-2-甲基-2H-噻吩并[2,3-e]-1,2-噻嗪-3-羧酸甲酯-1,1-二氧化物的制备
在反应瓶中加入二烷140ml和粉状甲醇钠5g,搅拌混合,加入5-氯-3-(N-甲氧基羰基亚甲基- N-甲基)氨基磺酰噻吩-2-羧酸甲酯32g(0.096mol),升至50 ºC,在该温度搅拌反应5h.冷却,倒入2mol/L盐酸300ml和二氯甲烷160ml中,充分搅拌后分相,水相用(20ml×2)二氯甲烷提取,合并有机相.用10%乙酸钠水溶液(100ml×2)、10%Na2CO3溶液(80ml×2)洗涤有机相,析出大量黄色固体.过滤,滤饼转入水100ml和CH2Cl2 160ml组成的混合液中,剧烈搅拌分散后,用浓盐酸酸化至pH2,分层,取有机相,用无水Na2SO4干燥.过滤,滤液浓缩至干后用甲醇60ml浸泡,过滤,干燥,得浅黄色晶体6-氯-4-羟基-2-甲基-2H-噻吩并[2,3-e]-1,2-噻嗪-3-羧酸甲酯-1,1-二氧化物22.4g,收率77.2%(文献[3,4]报道mp200~203 ºC,收率24.2%)mp200~202 ºC.
7. 氯诺昔康的合成
在反应瓶中加入二甲苯150ml和6-氯-4-羟基-2-甲基-2H-噻吩并[2,3-e]-1,2-噻嗪-3-羧酸甲酯-1,1-二氧化物16g(0.052mol),在N2保护下搅拌回流,并不断通入新鲜N2以夹带走生成的甲醇,于3h内滴入2-氨基吡啶的DMF-二甲苯溶液[2-氨基吡啶6.4g(0.068mol)溶于DMF15ml和二甲苯15ml混合液].滴毕,缓慢蒸出二甲苯约500ml.冷却析晶,过滤,干燥后得土黄色固体16.8g, 用二烷重结晶得亮黄色晶体氯诺昔康16.1g,收率83.7%,mp223~227 ºC.(分解)(文献[3,4]报道mp225~230 ºC)
用途
1.非甾体抗炎镇痛药.通过阻断环状氧合酶来抑制前列腺素的合成,但对酯质氧合酶无作用.
2.本品为选择性环氧合酶抑制剂类非甾体抗炎镇痛药.通过阻断环氧合酶来抑制前列腺素合成,但对酯质氧合酶无作用.本品的特点是抑制环氧合酶的作用比替诺昔康)吡诺昔康、吲哚美辛、双氯芬酸强100倍,抑制炎痛比替诺昔康强10倍,副作用较轻微,耐受性更好.临床主要用于风湿性和类风湿性关节炎、骨关节炎,也用于神经炎、神经痛、急性风痛、术后疼痛等,疗效优于替诺昔康等.
安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
【1】 Merck Index.13th:5603. 【2】 罗明生主编.现代临床药物大典.成都:四川科学技术出版社,2001:250. 【3】 US,4180662.1979. 【4】 DE,2838851.1979. 【5】 陈望忠.国外医学---药学分册,1997,24:168-171. 【6】 樊伟明等.中国医药工业杂志,2002,33:365-366. 【7】 郑艳彬等.国外医药:合成药,生化药,制剂分册,2001,22:166-169.
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号