| 物竞编号 | 017Y |
|---|---|
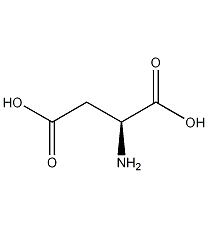
| 分子式 | C4H7NO4 |
| 分子量 | 133.1 |
| 标签 | L(+)-氨基丁二酸, L(+)-氨基琥珀酸, L-天门冬氨酸, L-天冬酸, (S)-(+)-Aminosuccinic acid, (S)-Aspartic acid, 生化试剂, 中间体 |
编号系统
CAS号:56-84-8
MDL号:MFCD00002616
EINECS号:200-291-6
RTECS号:CI9098500
BRN号:1723530
PubChem号:暂无
物性数据
1. 性状:无色斜方晶系叶片状或棒状晶体或结晶粉末,无臭。常为左旋光性。
2. 密度(g/mL,25/4℃): (d12.5/4)1.514
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):270-271
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,5.2kPa):未确定
7. 折射率:未确定
8. 闪点(ºC):未确定
9. 比旋光度(º):[a]20/D+25°(c=1.97,6mol/L盐酸中)。
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:溶于热水、酸、碱及盐溶液,不溶于乙醇和乙醚。
毒理学数据
1、急性毒性:小鼠腹腔LC50:6mg/kg
2、其它多剂量毒性:大鼠经口TDLo:25079mg/kg/7D-C
3、致突变性:姐妹染色单体exchangeTEST系统:人类淋巴细胞:10mg/L
生态学数据
暂无
分子结构数据
1、 摩尔折射率:27.20
2、 摩尔体积(cm3/mol):87.8
3、 等张比容(90.2K):261.3
4、 表面张力(dyne/cm):78.2
5、 极化率(10-24cm3):10.78
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:3
3.氢键受体数量:5
4.可旋转化学键数量:3
5.互变异构体数量:无
6.拓扑分子极性表面积101
7.重原子数量:9
8.表面电荷:0
9.复杂度:133
10.同位素原子数量:0
11.确定原子立构中心数量:1
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.常温常压下性质稳定。
2.为天然产物,无毒。
3.存在于烟叶、烟气中。
贮存方法
密封干燥保存。
合成方法
1.左旋天冬氨酸的制法有合成法和发酵法。1.合成法主要是以马来酸或富马酸或它们的酯为原料,在加压下用氨处理,然后水解。较容易合成得到外消旋天冬氨酸,但至今还没有理想的拆分外消旋体的方法。2.发酵法在酶作用下,将富马酸与氨加成,可高收率地得到产品。采用这种方法只生成左旋体,收率高,因此是工业生产的主要方法。
2.由反丁烯二酸、氨在三叶草假单胞菌或产氨短杆菌的天冬氨酸酶作用下得到。
3.以马来酸、富马酸或它们的酯为原料,在酶的作用下与氨加成。反应如下:
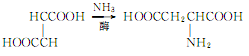
4.烟草:BU,22;FC,21。
用途
1.生化及医学临床研究。可作氨解毒剂,肝机能促进剂,疲劳恢复剂等医药品,可制L-天冬酸钠食品添加剂和各种清凉饮料的添加剂,还可作生化试剂、培养基和有机合成中间体。
2.可作为生化试剂、培养基和有机合成中间体。在医药上作为心脏病类药物、肝功能促进剂、氨解毒剂、疲劳消除剂和氨基酸输液的成分。也用于食品工业的保鲜剂等。
3.营养增补剂。添加于各种清凉饮料。医药上用作氨解毒剂、肝功能促进剂。化妆品中用作营养添加剂。
4.L-天冬氨酸常用作非对映烷基化反应的手性底物,并且可作为手性源合成其它手性化合物等。
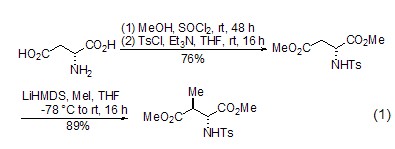
非对映选择性烷基化 L-天冬氨酸酯能够在α-和β-位发生烷基化 (式1)[2],其中β-烷基化反应的应用最为广泛。在β-烷基化反应进程中,氨基酸部分对该反应的非对映选择性有着重要的影响。同时,也可通过L-天冬氨酸的环状衍生物发生β-烷基化而制备β-二羰基化合物[3]。
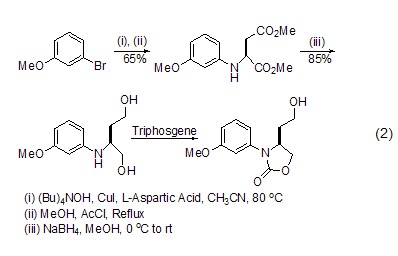
手性化合物的合成 以L-天冬氨酸为手性源,可以合成一系列手性化合物,如使用碘化亚铜、硼氢化钠等作用后,可以得到多官能团的氧氮杂环类化合物 (式2)[4],该化合物可进一步生成喹啉类化合物[4]。
酰胺键的形成 L-天冬氨酸作为氨基酸,与其它氨基酸一样也可生成酰胺类化合物 (式3)[5]。
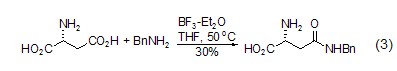
同时,还可以以L-天冬氨酸为母体,实现环内酰胺的合成。如合成六元环内酰胺 (式4)[6]。产物中还存在烷氧基,因此可作为另外一个反应位点进一步发生衍生化。
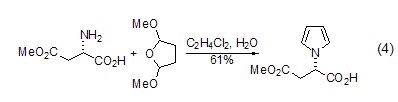
β-氨基酸(或氨基酸酯)的合成 L-天冬氨酸经过氨基保护、烷基化等步骤后,可生成β-氨基酸或氨基酸酯 (式5)[10],该反应实现了从天然氨基酸到非天然氨基酸的转化。
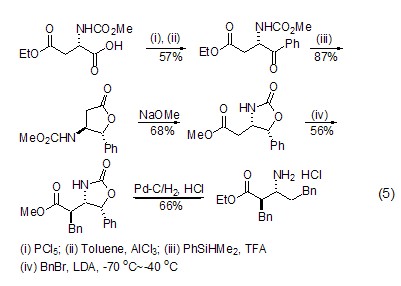
此外,L-天冬氨酸分子中含有两个羧基和一个氨基,因此可作为多齿配体与金属离子配位[7~9]或者自身形成内酯化合物[10,11]。
安全信息
危险运输编码:暂无
危险品标志: 易燃
易燃  有害
有害  刺激
刺激
文献
1. Marshall, J. A.; Andersen, N. H.; Schlicher, J. W. J. Org. Chem., 1970, 35, 858. 2. Goodenough, K. M.; Moran, W. J.; Raubo, P.; Harrity, J. P. A. J. Org. Chem., 2005, 70, 207. 3. Luppi, G.; Tomasini, C. Synlett, 2003, 6, 797. 4. Ding, K.; Flippen-Anderson, J.; Deschamps, J. R.; Wang, S. Tetrahedron Lett., 2004, 45, 1027. 5. van Leeuwen, S. H.; Quaedflieg, P. J. L. M.; Broxterman, Q. B.; Milhajlovic, Y.; Liskamp, R. M. J. Tetrahedron Lett., 2004, 45, 653. 6. Patel, J.; Pelloux-Leon, N.; Minassian, F.; Vallee, Y. J. Org. Chem., 2005, 70, 9081. 7. Anokhina, E. V.; Jacobson, A. J. J. Am. Chem. Soc., 2004, 126, 3044. 8. Rattat, D.; Eraets, K.; Cleynhens, B.; Knight, H.; Fonge, H.; Verbruggen, A. Tetrahedron Lett., 2004, 45, 2531. 9. Kobayashi, S.; Matsubara, R.; Nakamura, Y.; Kitagawa, H.; Sugiura, M. J. Am. Chem. Soc., 2003, 125, 2507. 10. Seki, M.; Shimizu, T.; Matsumoto, K. J. Org. Chem., 2000, 65, 1298. 11. Calvisi, G.; Dell'Uomo, N.; De Angelis, F.; Dejas, R.; Giannessi, F.; Tinti, M. O. Eur. J. Org. Chem., 2003, 4501. 12.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 13. Sason M, Matsuyama S. Nippon Sembai Kosha Chuo Kenkyusho Kenkyu Hokoku, 1978, 120: 1-6.
备注
暂无



 沪公网安备 31010602001115号
沪公网安备 31010602001115号