| 物竞编号 | 011C |
|---|---|
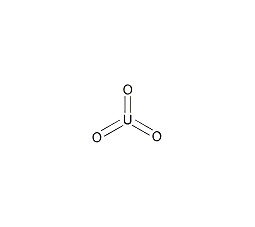
| 分子式 | UO3 |
| 分子量 | 286.03 |
| 标签 | 钪族元素 |
编号系统
CAS号:1344-58-7
MDL号:暂无
EINECS号:暂无
RTECS号:暂无
BRN号:暂无
PubChem号:暂无
物性数据
暂无
毒理学数据
暂无
生态学数据
暂无
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:3
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积51.2
7.重原子数量:4
8.表面电荷:0
9.复杂度:61.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
α-UO3呈红褐色,属六方晶系,a=6.878A(1A=0.1nm,下同),b=4.168A,计算密度为8.42g/cm3,测量密度为7.13g/cm3;β-UO3呈橙红色,属斜方晶系,c=14.3A,密度为7.29g/cm3,不溶于水,溶于盐酸和硝酸;γ-UO3呈黄色,属斜方晶系:a=9.71A,b=9.77A,c=19.92A,或单斜晶系:a=6.90A,c=19.92A,γ=90.57°;δ-UO3呈暗红色,属立方晶系,a=4.146A(O/U=2.82);ε-UO3呈红色,属三斜晶系,a=4.002A,b=3.841A,c=4.165A,α=98.10°,β=90.20°,γ=120.17°;ζ-UO3呈暗褐色;η-UO3属斜方晶系,a=7.511A,b=5.466A,c=5.224A;非晶型UO3呈橙色。
贮存方法
暂无
合成方法
无水的三氧化铀因制法的不同而存在着许多不同的相,但不论哪一种相,经高温加热,均分解为八氧化三铀U3O8。
制法1 α-UO3、β-UO3、γ-UO3:
将精制的硝酸双氧铀UO2 (NO3) 2·6H2O置于清洁的蒸发皿中,在空气中加热,慢慢从室温升至500℃,硝酸盐熔融后即分解为氧化物,在500℃下烧结12小时,然后迅速冷却,可得到α-UO3。若慢慢升温(3~5℃/min)至500℃,并连续加热2~3周,然后在炉子中自然冷却到室温,即可制得结晶性的γ-UO3。如果迅速升温[(30~40)℃/min],就生成β-UO3,但是如果在500℃下长时间(数周)连续加热,就会慢慢转变为γ-UO3,已知γ-UO3在1.01×103kPa以下的氧分压下为最稳定的形态。
δ-UO3:将无水三氧化铀(任何相均可)与水封于反应管中,加热至200~280℃时进行反应。反应所制得的产物(β-UO3·H2O等)在空气中375℃下加热24h以上时,即可制得δ-UO3。
ε-UO3:将U3O8在NO2气流中加热至250~375℃,可得到ε-UO3。
ζ-UO3:将金属铀溶于LiClO4中可制备得到ζ-UO3。
η-UO3:将UO3在2961atm氧气中加热至1100℃可得到η-UO3。
制法2β-UO3的制法
将氨水加入到硝酸双氧铀水溶液中,在pH=7~10的范围内生成黄色二铀酸铵沉淀,将此沉淀在空气中加热至500℃,就生成β-UO3。一般情况下,在这样的条件下β-UO3容易转变为γ-UO3,但使用含氨的盐经热分解所生成的β-UO3比较稳定。
非晶型UO3、α-UO3的制法。
将过氧化氢加入到硝酸双氧铀水溶液中,生成过氧化铀UO4·4H2O(温度在70℃以上时,就生成UO4·2H2O)。将过氧化铀充分洗净,彻底除去硝酸根离子后,在50℃以下进行干燥,干燥后放入蒸发皿中,在空气中缓缓加热至400℃(在200~225℃就分解为氧化物),并保持1~2h,过氧化物就完全分解,而制得非晶型的三氧化铀。
若过氧化铀没有被充分洗净,则会存在相当量(约5%)的硝酸根离子。将它在50℃以下干燥后,在空气中加热,至200℃时生成非晶型三氧化铀的水合物,温度升至400℃时就生成α-UO3。如果在550℃时加热1~2h,就可得到结晶性的α-UO3。在550℃以下即使长时间加热,三氧化铀水合物也不会完全分解,但在600℃以上时,由于会慢慢分解为八氧化三铀,所以加热时必须将温度保持在525~575℃的范围内。
用途
暂无
安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
None
备注
None




 沪公网安备 31010602001115号
沪公网安备 31010602001115号