逆流色谱分离手性化合物
- 2012-12-07
- 专题
手性化合物是自然界生命体中普遍存在的物质,其在医药、农药、香料等众多领域内起着非常重要的作用。为了满足对光学纯化合物的需要,各国科学家都在寻找有效、便捷的拆分手性化合物的技术[1],近年来逆流色谱在分离手性化合物上显示出了独特的优势。用逆流色谱分离手性化合物的主要优点是:逆流色谱是一种不用固态支撑体或载体的液液分配技术,在分离过程中完全消除了气、液色谱中常见的不可逆吸附现象,不会破坏分子,适用于分离极性大的手性化合物以及生物大分子[2];由于它独特的分离机制,使其可用于制备分离,一次最大可以分离近 10g 的样品[3]。逆流色谱技术主要可以分为液滴逆流色谱、旋转腔室逆流色谱以及离心分配逆流色谱三个大类,本文主要介绍这些逆流色谱的工作原理及其在分离手性化合物方面的应用。
1 液滴逆流色谱(DCCC)
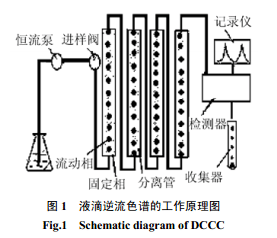
液滴逆流色谱仪(droplet countercurrent chromatography) 是Ito最早研发出来的[4]。它主要是通过在纵向排列的分离管柱里,用互不相溶的两相中的下相作固定相,将其先充满管柱,另一相作移动相,带着样品从管柱的下面往上连续通过分离管,由于重力的作用,移动相会在固定相中形成小液滴,样品将在移动相和固定相之间有效地进行分配。由于分配系数的不同,使得不同组分在分离柱中向前移动的速度不同,经过不断的分配传递之后,样品组份将按分配系数的大小顺序从管系的出口流出,从而达到分离的目的。图1表示出了DCCC仪器的装置示意图。
DCCC的分离效率完全取决于液滴的形成状况,只有当上升的小液滴具有最佳尺寸,刚好占据管柱的断面时,才能获得最好的分离效果。所以溶剂的选择很重要,常见的二元和三元溶剂系统有:己烷/水,氯仿/水,己烷/甲醇/水,氯仿/甲醇/水。
1984年Takeuchi等[5]从Davanoov等[6]合成N-正十二烷基脯氨酸(C12-Pro)中受到启发,使用当时流行的液滴逆流色谱仪(含400根直径为2cm的分离管,总容积为2L),用2mmol/L合成的正十二烷基-L-脯氨酸作手性添加剂,2mmol/L的正丁醇和 1mmol/L 的醋酸铜-醋酸缓冲溶液作溶剂系统,移动相流速保持1.1mL/min,花了2.5d 的时间,对亮氨酸对映异构体进行了基线分离,同时部分拆开了(±)缬草氨酸和(±)蛋氨酸。
两年后,Oya等[7]用(-)-R-2-氨基丁醇作手性添加剂,拆分了100mg 的二环[2.2.1]-庚-5-烯-2-羧酸衍生物,比传统的结晶法和酯化法拆分对映异构体的效果更好。所用仪器的柱容积是280mL,溶剂系统为氯仿/甲醇/磷酸盐缓冲溶液pH=7(7/13/8),耗时2.3d。由于液滴逆流色谱仅靠流动相在重力作用下形成液滴,洗脱速率很难提高,所以耗时较长。而且单靠在分离管中简单地上升或者下降的移动相所带来的溶质在两相中的反复分配是很有限的,分离效率也不高。而旋转腔室逆流色谱的发展在一定程度上弥补了液滴逆流色谱的不足。
2 旋转腔室逆流色谱(RLCC)
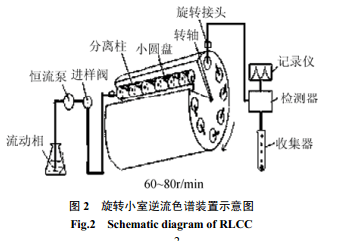
旋转腔室逆流色谱(rotation locular countercurrent chromatography) 是由多根装置在转轴周围的玻璃分离管柱组成,在管内应用聚四氟乙烯的小圆盘将空柱分成多个小腔室,这些小腔室少则几十个,多则可上百个。小圆盘的中心有一个直径大约为1mm的小穿孔,其作用是可以让流动相通过分离柱,当样品带朝向相邻的横向扩散时又会受到腔室间小穿孔的限制,这种机制能形成较高的分配效率。当移动相带着样品通过小腔室里面两相溶剂间的界面时,由于管柱在重力场中的旋转使样品带在每个腔室里面两相之间平缓而更有效地分离分配。与液滴逆流色谱相比,它大大增加了两相溶剂系统的相互作用,也增加了溶质在两相中的分配次数,从而提高了分离效果。该方法不要求流动相在固定相中一定能形成小的液滴,所以其大大扩展了流动相的选择范围,也拓展了该法的应用领域。
图2 是旋转小室逆流色谱装置示意图。
1982年Hostettman 等[8]用旋转腔室逆流色谱仪,首次在逆流色谱中使用R,R-酒石酸-二-5-壬基酯为手性添加剂[9],用1,2-二氯乙烷/水作溶剂系统拆分了200mg(±)旋光异构体麻黄碱。在分离过程中,0.3mmol/L手性试剂被加在作为移动相的有机相中,水相中加入0.5mmol/L 六氟磷酸钠缓冲溶液,样品用水相溶解,移动相流速为17~20mL/min,仪器旋转速度为60~70r/min,实验温度为2~3℃和5~8℃,一次进样花了3~4d,向人们展示了利用逆流色谱实现对旋光异构体分离的良好潜力。虽然旋转腔室逆流色谱分离效果比DCCC有所提高,但所需时间仍然较长,分离量不大。
3 离心分配逆流色谱(CPC)
离心分配逆流色谱(centrifugal partition countercurrent chromatography)是逆流色谱中内容最丰富的,各种不同的设备类型多达数十种。离心逆流色谱有两种基本的原理:流体动力学平衡体系(HDES)和流体静力学平衡体系(HSES)[10]。根据这些原理制造的仪器对应分为两个大类:行星式逆流色谱和非行星式逆流色谱。因它们都是具有离心力作用的两相溶剂系统,故又称为离心分配逆流色谱。
两相溶剂体系的选择对于这类逆流色谱成功分离样品十分关键。两相溶剂系统应满足以下要求[11]:(1)为了保证固定相保留值合适(不低于50%),溶剂体系的分层时间须小于30s;(2)手性样品在两相中的分配系数 K 最好在1左右;(3)尽量采用挥发性溶剂,以方便后续处理,易于样品纯化。
3.1 非行星式逆流色谱
这类逆流色谱仪与流体动力学平衡体系的逆流色谱不同,分离管柱固定在分离仪中,只公转,不自转。在众多的这类色谱中,目前真正还在得到应用的主要是匣盒式离心逆流色谱。匣盒式分离柱实际上是由一些小分离管组成,它们分布在离心转轴的周围,其纵轴与离心力平行,它们之间用聚四氟乙烯小管串联,工作时先泵入固定相,分离柱转动时,泵入移动相,移动相带着样品在分离柱中形成一连串液滴通过固定相,样品进行连续分配分离[12]。
Shinomiya先使用RLCC,用牛血清蛋白(BSA) 作手性添加剂拆分D,L-犬尿氨酸[13],花了60h仍没有得到基线分离,后改用离心分配色谱,溶剂系统10(wt)% PEG800作固定相,5(wt)% 的磷酸二氢钠缓冲溶液和6(wt)% BSA作移动相,转速800r/min,流速0.2mL/min,只耗时 3.5h 就成功拆分2.5mg D,L-色氨酸[14],说明CPC 的分离能力比RLCC更强。
3.2 行星式逆流色谱
在行星式逆流色谱仪中,分离柱采用了除了绕中心轴旋转外本身还作自转运动的模式。这种运动能造成两相溶剂反复剧烈混合和分层,其分配转移频率达到13次/s,使溶质达到比较理想的分离分配,因而用较少的溶剂就能快速有效地分离样品[15]。
Duret在用行星式逆流色谱仪(13mL 容积)进行手性拆分实验时,选用甲苯和水作溶剂系统,把在液相[16]、薄层色谱[17]、毛细管电泳[18]中有效的手性添加剂万古霉素借用过来,使水中溶解140mg/mL万古霉素,调整pH=4.7,拆分D,L-丹磺酰正亮氨酸。分离过程中,当从尾到头泵入移动相时,左消旋体被洗脱出来,当相反泵入移动相时,右消旋体被洗脱出来。实验表明用万古霉素也适用于作逆流色谱的手性添加剂,而且最大能分离50mg 的D,L-丹磺酰正亮氨酸[19]。
此种设备中最具有代表性的商业化仪器是高速逆流色谱仪(HSCCC),我国绝大多数的研究、应用以及国产仪器的生产也主要集中在该类型的色谱上,现予以专门详述。
4 高速逆流色谱
高速逆流色谱(High-speed countercurrent chromatography)是Ito 研发的新一代逆流色谱。目前国内研制的高速逆流色谱(HSCCC)仪器紧紧同国际最新发展相配合。该装置核心部件分离柱由多层聚四氟乙烯管绕成的线圈构成,多个线圈成对称分布或用平衡器平衡,因分离柱线圈旋转快,固定相保留多,两相作用充分,分离效果好,分离速度快,正被广泛用在众多领域的分离分析,在分离手性化合物上也得到了应用。图3即为高速逆流色谱仪装置示意图。

脯氨酸的衍生物是较早使用的逆流色谱手性添加剂,因为它们能提供π电子,易于对具有相似电荷特征的手性化合物进行拆分[20]。Pirkle等[21]使用高速逆流色谱,由这类手性添加剂在庚烷/乙酸乙酯/甲醇/水(体积比3/1/3/1)溶剂系统中较快(80min)拆开了两种DNB-氨基酸衍生物。随后,Ito等[22]使用这类具有π电子的手性添加剂,同样使用HSCCC,选用了两种溶剂系统:正己烷/乙酸乙酯/甲醇/10mmol/L 的盐酸(体积比 8/2/5/5)和正己烷/乙酸乙酯/甲醇/10mmol/L 盐酸(体积比6/4/5/5),成功分离了(±)DNB-苯甘酸、(±)DNB-苯丙酸等[23],通过改变手性添加剂在固定相中的量和浓度,一次进样最多能分离1g 量的手性样品[24,25]。
随着逆流色谱技术的逐步完善,分离能力的不断提高,使它能越来越多的借鉴其它色谱技术上的有效手性添加剂,这方面最好的例子是磺化-β-环糊精在高速逆流色谱上的成功应用。磺化-β-环糊精首先用在毛细管电色谱[26]上很成功地分离了7-去甲基-奥美昔芬(DMO)。由于磺化-β-环糊精已是商业化的产品,如果能用在逆流色谱上获得制备性分离,将有较大的应用前景。研究人员随后在高速逆流色谱上做了大量探索实验,最终选用乙酸乙酯/甲醇/水(体积比10/1/9)作溶剂系统,水相中含2%的磺化-β-环糊精作为手性添加剂,基线分离了(±)7-DMO[27]。为逆流色谱手性添加剂的选择打开了思路。
目前,笔者课题组主要进行高速逆流色谱仪分离手性药物的研究,如用羧甲基环糊精作手性添加剂对氨鲁米特和扑尔敏的外消旋体进行了制备性分离,用樟脑磺酸作手性添加剂对阿司咪唑和拉贝洛尔外消旋体进行了制备性分离,下面是在最佳色谱条件下分离扑尔敏外消旋体的色谱图,其最佳溶剂系统为:乙酸乙酯/甲醇/水(体积比10/1/9) ,最适合的手性添加剂浓度为20mmol/L[28]。

5 pH 区带精制逆流色谱
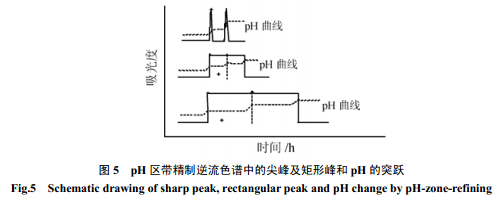
pH区带精制逆流色谱是上世纪90年代初期由Ito[29]提出后逐渐发展起来的,属于高速逆流色谱中的一项特殊技术,目前的文献报道都是在一般的高速逆流色谱仪上完成的。如在少量酸性物质的样品溶液中加入一定浓度的有机酸时,可以产生一个非同寻常的窄而尖的峰,当样品量增大时,每个组分将在柱中形成一个高度浓缩的等 pH 区带,并以一个矩形峰被洗脱出来,当样品量继续增大,矩形峰也随着增宽,但并不影响组分之间的分离效果,这就使该方法能在一般高速逆流色谱法的基础上成十倍地增加样品进样量,而不用对常见设备作任何改进。方法操作简单、易行、分离量大,有工业化应用的前景。图5示出了pH区带精制逆流色谱中的尖峰、矩形峰和 pH突跃。
pH区带精制逆流色谱技术是利用样品的 pKa 值和分配系数的不同进行质子交换来提纯样品的。它的分析分离可用下式表示:pH=pKa+log{KD/D(1+[CS]K±)-1},K±是(+)、(-)对映异构体与手性添加剂形成复合物的稳定常数,[CS]为在固定相中手性添加剂的浓度,(+)、(-)对映异构体的 pKa、KD是相同的,D是保留值,通过复合物的K+和K-的不同及手性添加剂在固定相中的浓度不同使对映异构体分开[27]。Oliveros等[20]用三氟乙酸作固定相、氨在水中作移动相,用330mL 容积的高速逆流色谱仪,经过 3h 分离了2g 的(±)DNB-亮氨酸[21]。pH区带提取逆流色谱已经成为分离量最大的制备分离手性化合物的逆流色谱技术。
随着越来越多的多糖、生物碱、氨基酸、抗生素等作为手性固定相在气液相色谱中不断获得成功[30],一些研究人员把寻找有效的逆流色谱手性添加剂的目光投到了天然产物和它们的衍生物上。当Linder 等[31]发现从金鸡纳树皮中提取的奎宁(QN)和奎宁定(QD)是一种有效的离子交换色谱的手性添加剂后,又在此基础上把奎宁和奎宁定衍生化为更强立体选择性的手性添加剂金刚烷基氨基甲酰基QN-Selector 1和金刚烷基氨基甲酰基QD-Selector 2,它们易于接受和失去质子,在分离氨基酸时立体选择性很好。图6为奎宁及其衍生化的手性添加剂的化学结构式。

通过使用高速逆流色谱,Franco 等[32]用0.1mmol/L pH6.0的氨基乙酸缓冲液/三戊基乙醇/甲醇/庚烷/( 体积比 10/5/1/5)作溶剂系统,含10.6mmol/L的手性添加剂,转速为1000r/min,流速3mL/min,很好地分离了DNB-亮氨酸、DNZ-新戊基甘氨酸和 DNZ-β-苯丙氨酸。用0.1mol/L pH8.0的氨基乙酸缓冲液/丙酮/甲基异丁基酮(MIBK)(体积比2/1/2)最大分离了300mg的DNB-亮氨酸。用pH区带精制逆流色谱,含三氟乙酸(10mmol/L)和QN-Selector 1 的MIBK溶液作固定相,含20mmol/L的氨水作移动相,转速为1200r/min,流速3mL/min,最大分离了1.2g的DNB-亮氨酸。
6 结语
目前利用逆流色谱分离手性化合物的论文还不多,制约着手性分离的主要因素是能否找到合适的高选择性手性添加剂。根据逆流色谱分离手性化合物的报道,从气、液、毛细管电泳中广泛使用的手性添加剂中,找到适合于逆流色谱的手性添加剂,仍然是一个很好的途径。随着高效手性添加剂的发现和逆流色谱仪器的进一步更新完善,逆流色谱制备性分离手性化合物的能力将会进一步提高,关于这方面的研究和应用也将会进一步加深和扩大。
参考文献
[1] N M Maier, P Franco, W Lindner. J. Chromatogr. A, 2001, 906: 3~33.
[2] A P Foucault, L Chevolot. J. Chromatogr. A, 1998, 808: 322.
[3] A Marston, I Slacanin, K Hostettmann. Physochemical Analysis, 1990, 1: 3~17.
[4] N K Hostettman. Planta Medica, 1980, 39: 1~18.
[5] V A Davankov, A S Bochkov, Y P Belov. J. Chromatogr., 1981, 218: 547~557.
[6] T Takeuchi, R Horikawa, T Tanimura. J. Chromatogr., 1984, 284: 285~288.
[7] S Oya, J K Snyder. J. Chromatogr., 1986, 370: 333~338.
[8] B Domon, K Hostettmann, K Kovacevic et al. J. Chromatogr., 1982, 250:149~151.
[9] V Prelog, Z Stojanac, K Kovacevic. Helv. Chim. Acta., 1982, 65: 377~384.
[101] A Berthod, D W Armstrong. J. Liq. Chromatogr., 1988, 11: 547~583.
[11] Y Ito, W D Conway . High-speed Counter-current Chromatography, Chemical Analysis. New York:Wiley, 1996: 121~175.
[12] Y Ito. Crc. Crit. Rev. Anal. Chem., 1986, 17: 65~143.
[13] F Oka, H Oka, Y Ito. J. Chromatogr., 1991, 538: 99~108.
[14] T Arai, H Kuroda. Chromatographia , 1991, 32: 56.
[15] D W Armstrong, Y Tang, S Chen et al. Anal. Chem., 1994, 66: 1473~1484.
[16] D W Armstrong, Y Zhou. J. Liq. Chromatogr., 1994, 17: 1695~1707.
[17] D W Armstrong, K Rundlett , G L Reid III . Anal. Chem., 1994, 66: 1690~1695.
[18] P Duret , A Foucault, R Margraff . J. Liq. Chromatogr, 2000, 23: 295~312.
[19] Y Ito, M Weinstein, I Aoki , R Harada et al. Nature, 1966, 212: 985.
[20] L Oliveros, P P Franco, C Minguillon et al. J. Liq. Chromatogr., 1994, 17: 2301~2318.
[21] W H Pirkle, P G Murray. J. Chromatogr., 1993, 641: 11~19.
[22] Y Ma, Y Ito, A Foucault. J. Chromatogr. A, 1995, 704: 75~81.
[23] Y Ma, Y Ito. Anal. Chem., 1995, 67: 3069~3074.
[24] YMa, Y Ito. Anal. Chem., 1996, 68: 1207~1211.
[25] Y Ma, Y Ito, A Berthod. J. Liq. Chromatogr., 1999, 22: 2945~2955.
[26] J Breinholt, S V Lehmann, A R Varming. Chirallity, 1999, 11: 768~771.
[27] A P Foucault. J. Chromatogr., 2001, 906: 365~378.
[28] L M Yuan. J C H Liu. Z H Yan et al. J. Liq. Chromatogr., in press.
[29] A Weisz , A L Scher, K Shinomiya et al. J. Am. Chem. Soc., 1994, 116: 704~708.
[30] G Subramarian. Chiral Separations Techniques. A Practcical Approach. 2nd ed.; Weinheim: Wiley-VCH, 2001. 46.
[31] W Lindner, M Lammerhofer, N M Maier. PCT/EP: 97/02888, 1997.
[32] P Franco, J Blanc, W R Oberleitner et al. Anal. Chem., 2002, 74: 4175~4183.
注:本文为提供者整理翻译的,由于知识所限,错误在所难免,敬请原谅。如有问题可以查找原文。



 沪公网安备 31010602001115号
沪公网安备 31010602001115号