绿色化学之离子液体-有用的反应溶剂
- 2012-03-31
- 专题
近年来,从绿色化学的角度出发,更多研发人员投入到环境友好反应的过程研究中。例如,空气中的氧化反应,水、超临界流体和氟溶剂中的反应。最近,离子液体作为有机合成的绿色反应溶剂引起很多关注。
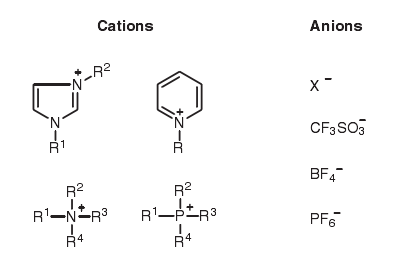
如上图所示,离子液体是盐类,由阳离子和阴离子构成,阳离子如咪唑鎓、吡啶鎓、季铵基和季磷基,阴离子如卤素离子、三氟甲磺酸根、四氟硼酸根和六氟磷酸根,在相对低温下离子液体以液体状态存在。他们的显著特征包括几乎无蒸气压、不易燃、不可燃、高热稳定性、相对低的粘度、作为液体较宽的可操作温度范围和高离子导电性。当离子液体用作反应溶剂时,溶质仅仅被离子溶解,这样与以水或普通有机溶剂相比,反应在完全不同的情况下进行。因此,离子液体被期望呈现非传统的反应性,而且在各种有机反应中的应用不断被发掘。
包含氯铝酸根阴离子的离子液体已经被研究多年。这些离子液体不仅仅用作反应溶剂,当阴阳离子的比例改变时,它们还表现出路易斯酸或路易斯碱的性质。然而,因为对湿度的高灵敏性,他们只能在惰性气体或者真空中反应。另一方面,研究人员发现含有如六氟磷酸根阴离子的离子液体能在空气中形成稳定的盐类,这样引导了今天大量稳定的离子液体的合成。而且,一些离子液体在水和极性有机溶剂中溶解度很小,利用这个特性,离子液体可以在有机溶剂萃取产物后回收利用。传统溶剂很少被重复利用,这样可以减少传统溶剂的浪费。另外,离子液体作为安全溶剂,由于其低挥发性得到很多关注。
下面是一些离子液体的应用示例:
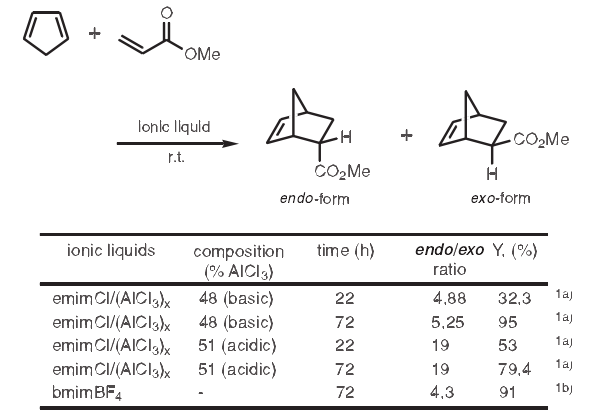
1. Diels-Alder反应
环戊二稀和丙烯酸甲醋的Diels-Alder反应已见报道。在该反应中使用1-乙基-3-甲基咪唑氯化物/氯铝酸盐[emimCl/(AICI3)x],内/外型产物比随着emimCl/(AICI3)x比率的变化而变化很大。相比碱性emimCl/(AICI3)x,使用酸性emimCl/(AICI3)x时内型数量增加4倍。1a)当1-丁基-3-甲基甲基咪唑鎓四氟硼酸盐(bmimBF4)进行相同反应时,它表现了与路易斯碱emimCl/(AICI3)x相似的反应性。1b)
2. Heck反应
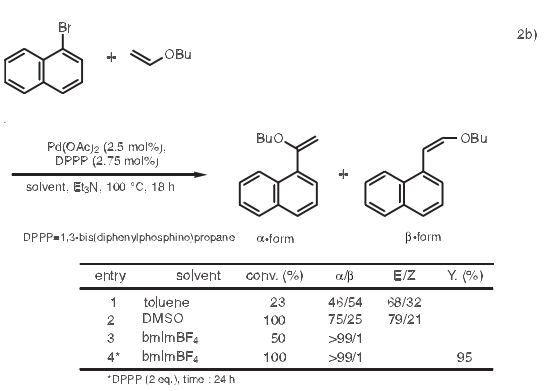
Heck反应中用到钯类催化剂,极性溶剂如DMF和乙睛,基质通常为芳基碘化物。如果使用价格较便宜但反应性较低的芳基溴化物或氯化物,必须使用更多的活性催化剂或者添加磷配体来保持催化剂的活性。用1-丁基-3-甲基咪唑鎓溴化物(bmimBr)作溶剂,在不添加磷配体的情况下,芳基溴化物和苯乙烯反应得到高产量的芪类化合物。2a)

具有给电子基团的烯醇醚与芳基卤化物反应,在正常Heck反应条件下,生成α-取代和β取代的混和物。然而,当使用bmimBF4作溶剂,乙烯醚和芳基卤化物反应只特定生成α-取代物。2b)另外,已经有报道使用季铵盐四丁基溴化按(Bu4NBr)的Heck反应。2c)
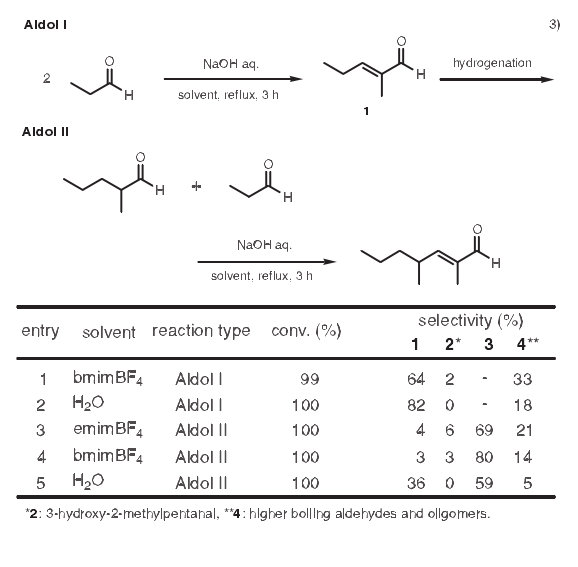
3.羟醛缩合反应
使用离子液体的羟醛缩合反应已见报道。在反应中,为了从丙醛通过两个羟醛缩合反应得到2.4-二甲基-2-庚烯醛3,在羟醛缩合反应Ⅰ中,离子液体相中的转化率和水介质中的相当。然而,如下表数值所示,产物的选择性降低了。这要归咎于产物1在离子液体中溶解度高而引发了副反应。相反,与水中反应相比,在羟醛缩合反应Ⅱ中,离子液体相中产物的选择性增强了。这是因为1的氢化产物在水中难溶而在离子液体中易溶。3)
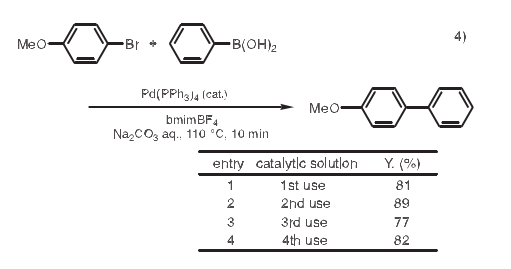
4. Suzuki-Miyaura偶联反应
Suzuki-Miyaura偶联反应中,在钯催化剂和碱存在的条件下,芳基卤化物和芳基硼酸生成联芳基化合物,然而催化剂的去除一直是个难题。在利用离子液体作溶剂的体系中,反应完成后产物可以用醚萃取得到,而催化剂仍留在离子液体中,然后离子液体和催化剂可以被重复利用。4)
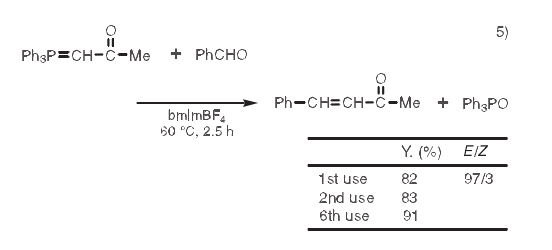
5. Wittig反应
Wittig反应是一个形成碳碳双键的有用方法。然而,产物和副产物三苯基氧化膦的分离是个经典难题。通常利用结晶或色谱进行分离纯化。当利用离子液体作溶剂,反应完成后,结合醚萃取和甲苯萃取,产物和氧化膦很容易被分离。另外,离子液体有可能被有效的重复利用。5)
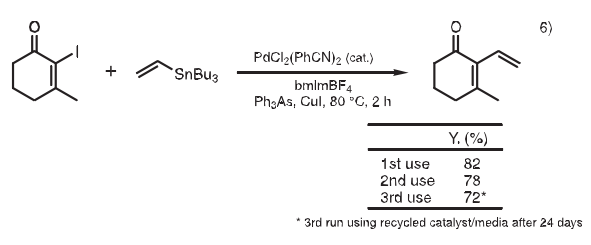
6. Stille反应
Stille反应是很有用的反应,在钯催化剂存在条件下,有机锡化合物和亲电试剂反应,在温和条件下生成C-C键。在离子液体中,乙烯基三丁基锡和碘代环己烯酮反应,产物可以用醚萃取,而催化剂留在离子液体中。离子液体和催化剂可以被重复利用。该离子液体/催化剂相对空气和潮湿稳定,因此可以在长时间储存后使用而不损失活性。6)
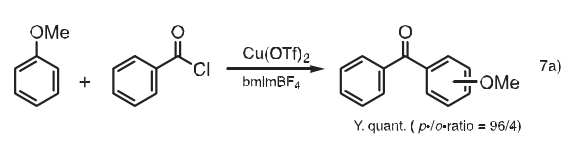
7. Friedel-Crafts反应
下面是Friedel-Crafts反应的一个例子。在bmimBF4中,三氟甲磺酸铜催化苯甲醚的苯甲酰化反应,甲氧基二苯甲酮在1h内能够定量得到,其中对位/邻位产物的比率为96/4。7a)在乙睛中进行同样的反应,1h内转化率较低,为64%,其中对位/邻位产物的比率为93/7。另外,利用emimCl/(AICI3)x,吲哚类的区域选择性酰化也已见报道。
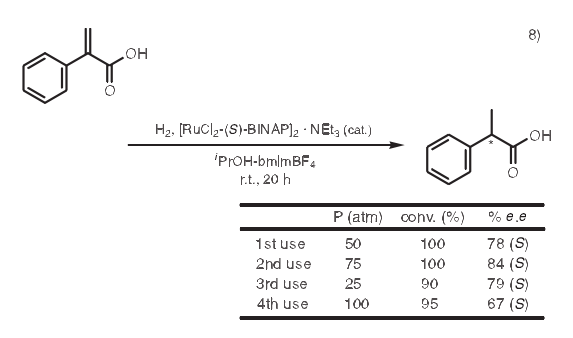
8.加氢作用
在使用均相手性过渡金属络合物的碳碳双键不对称加氢作用中,催化剂的回收率和产物的分离经常让人困扰。8) Dupont等曾经报道过一个例子,其中试剂可以在离子液体和醇的两相体系中反应。反应进行完全后,产物留在醇相,而催化剂留在离子液体相中。因此产物和催化剂可以很容易通过倾析分离。另外,留在离子液体中的催化剂可以被重复利用而不损失活性。
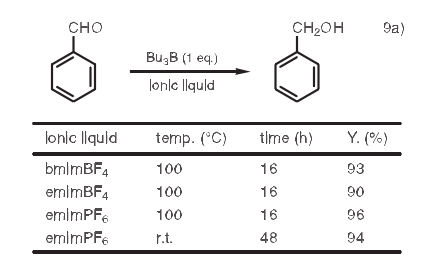
9.还原反应
利用三烷基硼烷的醛还原反应是一个重要的有机转化反应。然而,使用简单的三烷基硼烷的还原反应一般需要150℃以上的反应温度。Kaballa等曾经报道了这种还原反应,利用bmimBF4, emimBF4、和1-乙基-3-甲基咪唑鎓六氟磷酸盐(emimPF6)作溶剂。9a)例如,当苯甲醛在emimPF6中被三丁基硼烷还原时,反应在100℃时进行很快,并且产量很高。产物在室温下也可以得到,尽管相对而言需要较长的反应时间。另外,利用离子液体的光致还原反应也已见报道。9b)
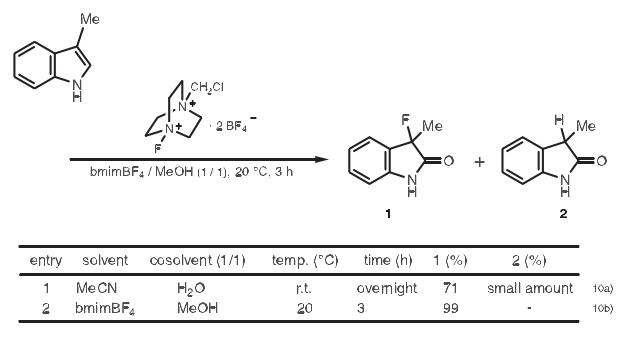
10.氟化反应
在杂环化合物中引进氟在生物活性化合物的合成中很重要。利用N-氟-N'-(氯甲基)三乙烯二胺双(四氟硼酸盐)作氟化试剂,bmimBF4作溶剂,发生吲哚类的亲电氟化反应,与传统方法(下表行1)相比,在较短时间内可以得到高产量的3-氟-2氧代吲哚类化合物。
11.开环反应
β-氨基醇可以用作生物活性化合物的合成中的有用砌块。有一种合成方法是利用胺类使环氧化物开环。然而,这些反应在较高温度下需要用到大量过量的胺类。高温反应条件不仅会破坏某些功能团,而且还不利于控制区域选择性。随后发展了多种催化剂或助催化剂如金属氨基化合物、金属三氟甲磺酸盐和过渡金属卤化物。然而,因为它们大部分价格昂贵或者需要化学计量的量,从而限制了它们的实用性。在利用离子液体的体系中,反应在室温下进行,可以高产量的得到β-氨基醇。11)
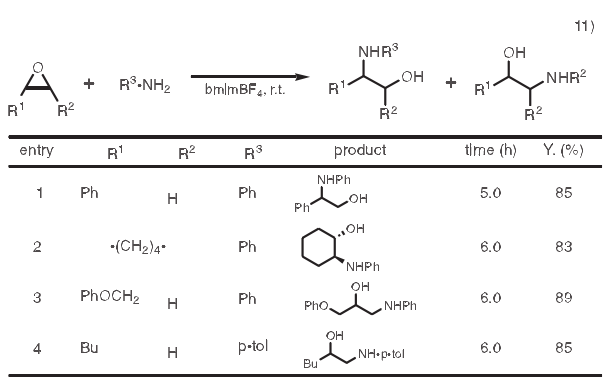
上表行3,4中缩水甘油醚或烷基环氧乙烷为例,胺类攻击环氧化物上空间位阻较小的位点。反应后,产物用醚萃取,接着在80℃下减压干燥。离子液体可以被重复利用五次而不损失活性。
12.酶反应
利用离子液体的酶反应已见报道。12)众所周知,脂肪酶可以在非天然的反应条件下保持活性,在有机溶剂中的反应已被大量使用。例如,有机溶剂中的醋基交换反应是一种制备光学活性化合物的很有用的合成方法。在利用离子液体的烯丙醇的不对称醋基交换反应中,目标产物的产率和在有机溶剂体系中得到的相近。12a)

如上所述,多种利用离子液体的反应已被使用,提高产率和回收率的改进方法和溶剂的循环利用已见报道。此外,他们也被报道在烃化13)、烯丙基化14)、环氧化15)、环加成16)、氢化醋化17)和使用超临界CO2的反应18)中有效。
13.其他应用
离子液体在电化学中的应用也引发了关注,因为它们仅仅由离子构成,而且具有高的离子导电性。例如,它们作为二次电池电解质得到广泛研究。这些电解质需要具有如下特性:高离子导电性,不易挥发性,热稳定性,不燃性以及无腐蚀性。离子液体正好满足这些要求。此外,1-烷基-3-甲基咪唑鎓碘化物近期被研究作为染色敏化太阳能电池的一种电解质。19)
最近,Hamaguchi等在报告中指出1-丁基-3-甲基-咪唑鎓四氯高铁酸盐是具有磁性的离子液体。20)传统的磁性液体在挥发性和相分离问题上是个难题。这种新的磁性离子液体正好解决了这些问题,被期望用在多种领域,包括用作电机轴的密封剂。
References
1) a) C. W. Lee, Tetrahedron Lett. 1999, 40, 2461; b) T. Fischer, A. Sethi,T. Welton, J. Woolf, Tetrahedron Lett. 1999, 40, 793.
2) a) L. Xu, W. Chen, J. Xiao, Organometallics 2000, 19, 1123; b) L. Xu,W.Chen, J. Ross, J. Xiao, Org. Lett. 2001, 3, 295; c) V. P.W.Bohm,W.A. Herrmann, Chem. Eur. J. 2000, 6, 1017.
3) C. P. Mehnert, N. C. Dispenziere, R. A. Cook, Chem. Commun. 2002,1610.
4) C. J. Mathews, P. J. 5m ith, T. Welton, Chem. Commun. 2000, 1249.
S) V. L. Boulaire, R. Gree, Chem. Commun. 2000, 2195.
6) S. T. Handy, X. Zhang, Org. Lett. 2001, 3, 233.
7) a) J. Ross, J. Xiao, Green Chem. 2002, 4, 129; b) K.-S. Yeung, M. E.Farkas, Z. Qiu, Z. Yang, Tetrahedron Lett. 2002, 43, 5793; c) A. Stark,B. L. MacLean, R. D. Singer,J. Chem. Soc., Dalton Trans. 1999, 63; d)C. J. Adams, M. J. Earle, G. Roberts, K. R. Seddon, Chem. Commun.1998, 2097.
8) A. L. Monteiro, F. K. Zinn, R. F. de Souza, J. Dupont, Tetrahedron:Asymmetry 1997, 8, 177.
9) G. W. Kabalka, R. R. Malladi, Chem. Commun. 2000, 2191; b) J. L. Reynolds, K. R. Erdner, P. B. Jones, Org. Lett. 2002, 4, 917.
10) a) Y. Takeuch i, T. Taru i, N. Shibata, Org. Lett. 2000, 2, 639; b) J.Baudoux, A.-F. Salit, D. Cahard, J.-C. Plaquevent, Tetrahedron Lett.2002, 43, 6573.
11) J. S. Yadav, B. V. S. Reddy, A. K. Basak, A. V. Narsaiah, TetrahedronLett. 2003, 44, 1047.
12) a) T. Itoh, E. Akasaki, K. Kudo, S. Shirakami, Chem. Lett. 2001, 262;b) R. M. Lau, F. van Rantwijk, K. R. Seddon, R. A. Sheldon, Org. Lett.2000, 2, 4189; c) S. Park, R. J. Kazlauskas, J. Org. Chem. 2001, 668395; d) T. Itoh, S.-h. Han, Y. Matsushita, S. Hayase, Green Chem.2004, 6, 437; e)T.Ito, Vuki Gosei Kagaku Kyokaishi (J. Synth. Org.Chem. Jpn.) 2009, 67, 143.
13) M. Badri, J.-J. Brunet, Tetrahedron Lett. 1992, 33, 4435.
14) C. M. Gordon, A. McCluskey, Chem. Commun. 1999, 1431.
15) G. S. Owens, M. M. Abu-Omar, Chem. Commun. 2000, 1165.
16) a) J. Peng, Y. Deng, New J. Chem. 2001, 25, 639; b) J. F. Dubreuil, J.P. Bazureau, Tetrahedron Lett. 2000, 41, 7351.
17) a) K. Qiao, Y. Deng, New J. Chem. 2002, 26, 667; b) D. Zim, R. F. deSouza, J. Dupont, A. L. Monteiro,Tetrahedron Lett. 1998, 39, 7071.
18) S. V. Dryuba, R. A. Bartsch, Angew. Chem. Int. Ed. 2003, 42, 148.
19) a) P. Bonhote, A.-P. Dias, N. Papageorgiou, K. Kalyanasundaram, M.Gratzel, Inorg. Chem. 1996, 35, 1 168.
20) a) S. Hayashi, H. Hamaguchi, Chem. Lett. 2004, 33, 1590; b)H.Hamaguch i, Expected Materials for the Future (Mirai Zairyo) 2005, 5,29
Reviews
21) a) T. Welton, Chem. Rev. 1999, 99, 2071; b) J. D. Holbrey, K. R. Seddon, Clean Prod. Proc. 1999, 1, 223; c) P. Wasserscheid, W. Keim, Angew. Chem. Int. Ed. 2000, 39, 3772;
d) R. Sheldon, Chem. Commun. 2001, 2399; e) D. Zhao, M. Wu, Y. Kou, E. Min, Catal. Today 2002,74, 157.
注:本文为提供者翻译的,由于知识所限,其中错误在所难免,敬请原谅。如有问题可以查找原文



 沪公网安备 31010602001115号
沪公网安备 31010602001115号