具有生物活性的单氟化合物的合成
- 2012-05-25
- 专题
将氟引入一生物活性化合物和一农药的某一位置,可显著减少化合物的毒性,或改善药效。这可能是由模仿和阻断作用造成的。模拟作用是有几天的代谢途径很容易纳入带有C-F键化合物的现象。这是因为氟原子很小,所以C-H键和C-F键之间没有明显的立体差异。阻断作用是氟原子的电负性降低周围电子密度的现象,并阻挡程序中的某些反应,例如氧化反应。氟类固醇和5-氟-尿嘧啶衍生物是氟化作用的例子(图1)。
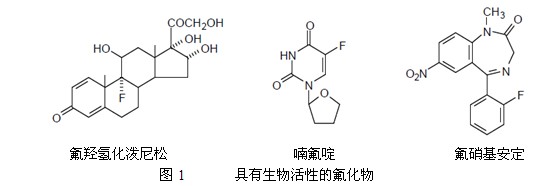
由于很少出现天然的含氟化合物,所以必须在合成的某一阶段使有机化合物与氟素化合。虽然把氟气和氟化氢作为氟源,但是它们的毒性和腐蚀性很大,而且需要特殊的仪器和技术来操作它们。因此,已经发明出代替氟化剂的试剂,在实验室中使用它很容易在化合物选定位置上引入氟原子。粗略的将氟化剂划分为两类:亲核额和亲电的。亲核氟化剂是这些作为反应活性物种的氟化物阴离子。亲电氟化剂是这些作为反应活性物种的缺电子氟化物。另外,作为氟源使用含氟的构建模块,它在一个分子中同时拥有氟原子和可替换的功能团。
1.亲核氟化试剂
最基础的亲核氟化试剂是氟化氢,氟化合物的工业产品大量使用它。然而,由于它的毒性、腐蚀性以及由H-F的高键能造成的低反应活性,在实验室中极少使用氟化氢。像KF、CsFB和Bu4N·F这样的亲核氟化试剂很容易得到。这些氟化试剂易潮,而不幸的是在这些成分中的水分与氟化物阴离子形成强氢键,并导致反应活性的降低。有人已经研制出了“裸”氟化物阴离子,即氟化物阴离子完全自由于氢键。举个例子,三丁基胺二氟三丙基锡酸盐1(由M.Gingrasas报道作为Bu4N·F的替代试剂)是防潮的,在高温中有很好的稳定性而且在有机溶剂中有很高的溶解度。1)A.G.Martines等用物质1从醛合成gem-氟三氟。2)
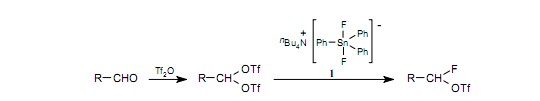
作为一种强氟化试剂使用TASF2。3)它易潮,但很容易获得无水晶体。三(二甲基氨基)锍的电荷并不是集中在S原子上,而是扩散到整个基团。因此,(Me2N)3S+ 和Me3SiF2-间的静电作用比较弱。Me3SiF2-分离成Me3SiF和F-,释放了一个氟化物阴离子源后在有机溶液中是易溶的。W.A.Szarek等已经演示了在温和环境下,来自糖三氟的二氧氟糖的合成方法。

在很多种合成工艺中使用DAST3,用它使氟原子立体具体取代羟基团。4)A.P.Kozikowski等已经发明了两步从白坚木醇生产(-)-氟-myo-纤维醇的方法。5)他们称,在这种方法中,DAST3与白坚木醇两个轴向羟基中的一个反应生成一个DAST中间体,它可以极大地增强羟基的离去能力。与硬酯反演协同,通过氟化物阴离子作用,使一个容易的羟基亲核取代发生成为可能。物质3高温下不稳定,而且经过加热大幅度分解。然而,通常在室温或较低温度下,在一个短时间完成使用3的反应。

促进氟化物阴离子攻击的另一种方法是通过产生碳正离子。通过氧化有机化合物可以生产碳正离子。因此,氧化剂和氟化试剂的联合使用是简单的氟化作用成为可能。另外,通过选择一种氧化剂,选择性氟化成为可能。使用三丁基氨基二氢三氟化物4和NIS,Kuroboshi等已经获得从烯烃到氟碘代烷烃的合成方法。6)

电解氧化也可作为一种氧化有机化合物的方法。因为没有使用氧化剂的简单反应系统,所以通过这种方法可以很容易对目标物质进行提纯。
2. 亲电氟化试剂
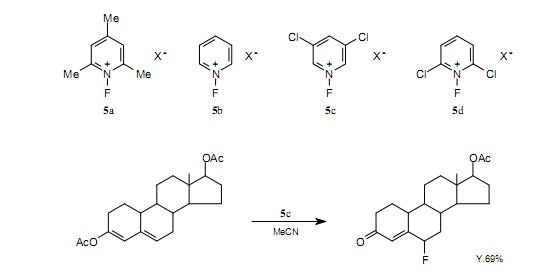
在亲电氟化试剂中,基本试剂是氟气,由于它的较高反应活性所以并不适用于部分氟化,同时它有强毒性。Umerzawa等报道说,N-氟-吡啶盐5是一种稳定并且易于操作的晶体,而且它具有较高的活性。7)通过将吸电子基团或给电子基团引入吡啶环中,可以增加或减小氟化能力。举个例子,氟化能力以5a,5b,5c和5d的顺序增加,下面显示了它们的结构。通过为实验选择一个合适的反映试剂,抑制副反应和改善收率是可能的。
在1988年,E.Differding等第一次成功合成非对称氟化试剂,N-氟樟脑磺内酰胺6。8)这允许以70%的对映体过量的碳负离子非对称氟化。

3. 含氟构建模块
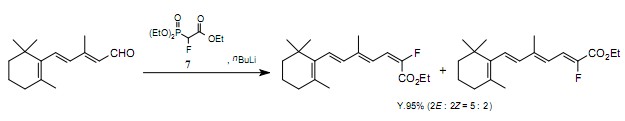
最近,同时拥有一个氟原子和可替代功能团的含氟构建模块,作为一种易得的氟源使用。特别是,在同一碳原子上同时含有一个氟原子和一个吸电子基团的化合物,作为一种对合成生理活性化合物有效地含氟构建模块来使用。为生成能够与亲电子试剂反应的氟-碳负离子,用碱与这类化合物进行处理。举个例子,在碱存在时,三乙基2-氟-2-磷酰基乙酸盐79)生成一个氟-碳负离子。与羰基化合物一起,阴离子的Hormer-Emmons反应生成α-氟-α,β-不饱和酸酯。这些酯能被还原成醛和醇,而且它们是生成很多生理活性化合物的非常有用的前驱体。合成的化合物(维他命A衍生物10),昆虫外生物激素11)和有杀虫作用的拟除虫菊酯12))是与物质7一起生成,具有生理活性含氟物质的主要实例。
O.Piva观察到通过254nm光的照射,在碱存在时,α-氟-α,β-不饱和酸酯可转化成α-氟-β,γ-不饱和酸酯。如果一种光学活性的胺作为碱来使用,可优先得到光学对映体中的任一种。13)
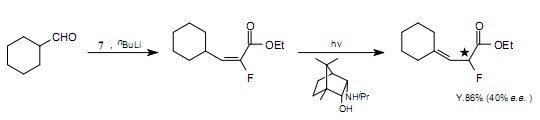
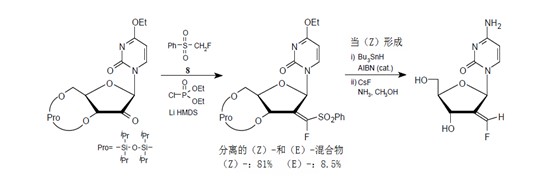
氟甲基苯基砜在同一个碳原子上具有氟原子和磺酰基,在碱存在时生成氟-碳负离子。14)这些阴离子与羰基化合物反应生成α-氟-β-羟基苯基砜衍生物。这种砜可转化成α-氟-α,β-不饱和砜和氟乙烯基衍生物。J.R.McCarthy等报道了一种方法,这种方法使用物质8能够将氟烯基单元立体选择地引入核苷。15)
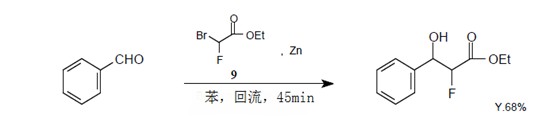
甲基溴氟乙酸9在同一个碳原子上具有一个溴原子,一个氟原子和一个羰基,与锌反应生成瑞福马斯基试剂。这种瑞福马斯基试剂与羰基化合物反应生成α-氟-β-羟基酯,16)与N-(α-氨烷基)苯三唑化合物反应生成α-氟-β-氨基酯。17)Takeuchi等使用物质9合成了N-保护α-氟-α-氨基酯,而且报道了它的化学性质的详细资料。18)
在这描述的氟化试剂和含氟构建模块只需要普通的有机合成方法。生成含氟有机化合物不需要特殊仪器和技术。生成许多药物和农药已经使用了这些氟化试剂。
参考文献
1) M. Gingras, Tetrahedron Lett., 32, 7381 (1991).
2) A. G. Martinez, J. O. Barcina, A. Z. Rys, L. R. Subramanian, Tetrahedron Lett., 33, 7787 (1992); idem, Synlett, 1993, 587.
3) W. A. Szarek, G. W. Hay, B. Doboszewski, J. Chem.Soc., Chem. Commun., 1985, 663; P. J. Card, W. D. Hitz, J. Am. Chem. Soc., 106, 5348 (1984).
4) L. N. Markovskij, V. E. Pashinnik, A. V. Kirsanov, Synthesis, 1973, 787; W. J. Middleton, J. Org. Chem., 40, 574 (1975); M. Hudlicky, Org. React., 35, 513 (1988); Wm. Rosenbrook, Jr., D. A. Riley, P. A. Lartey, Tetrahedron Lett., 26, 3 (1985).
5) P. A. Kozikowski, A. H. Fauq, J. M. Rusnak, Tetrahedron Lett., 30, 3365 (1989).
6) M. Kuroboshi, T. Hiyama, Tetrahedron Lett., 32, 1215 (1991).
7) T. Umemoto, K. Tomita, Tetrahedron Lett., 27, 3271 (1986).
8) E. Differding, R. W. Lang, Tetrahedron Lett., 29, 6087 (1988).
9) S. Kikuchi, T. Onosawa, Journal of Synthetic Organic Chemistry, Japan, 55, 88 (1997).
10) R. S. H. Liu, H. Matsumoto, A. E. Asato, M. Denny, Y. Shichida, T. Yoshizawa, F. W. Dahlquist, J. Am. Chem. Soc., 103, 7195 (1981); A. J. Lovey, B. A. Pawson, J. Med. Chem., 25, 71 (1982).
11) F. Camps, J. Coll, G. Fabrias, A. Guerrero, Tetrahedron, 40, 2871 (1984).
12) Ph. Coutrot, C. Grison, R. Sauvetre, J. Organoment. Chem., 332, 1 (1987).
13) O. Piva, Synlett, 1994, 729.
14) M. Inbasekaran, N. P. Peet, J. R. McCarthy, M. E. LeTourneau, J. Chem. Soc., Chem. Commun., 1985, 678.
15) J. R. MaCarthy, D. P. Matthews, D.M. Stemerick, E. W. Huber, P. Bey, B. J. Lippert, R. D. Snyder, P. S. Sunkara, J. Am. Chem. Soc., 113, 7439(1991).
16) E. T. McBee, O. R. Pierce, D. L. Christman, J. Am. Chem. Soc., 77, 1581(1955); S. Brandange, O. Dahlman, L. Morch, ibid., 103, 4452(1982).
17) A. R. Katriazky, D. A. Nichols, M. Qi, Tetrahedron Lett., 39, 7063(1998).
18) Y. Takeuchi, M. Nabetani, K. Takagi, T. Hagi, T. Koizumi, J. Chem. Soc. Perikin Trans. 1, 1991, 49; Y. Takeuchi, K. Takagi, T. Yamaba, M. Nabetani, T. Koizumi, J. Fluorine Chem., 68, 149(1994).
注:本文为提供者翻译的,由于知识所限,其中错误在所难免,敬请原谅。如有问题可以查找原文。



 沪公网安备 31010602001115号
沪公网安备 31010602001115号