分子胶囊:带有隔离纳米腔的容器化合物
- 2012-05-25
- 专题
1. 引言
生命活动的维系需要消耗能量,这些能量的提供要通过一系列的过程:从环境中摄入食物,食物的分解,并在体内将其代谢。生物膜是贯穿这一系列过程的重要场所。生物膜是由脂类在疏水作用的驱动下通过自组装形成的,并且在细胞的内外分别形成边界。它保护细胞免受外来物质的入侵,同时作为能量交换、物质传递的媒介,必要时也是信号传输的媒介。在特殊环境下,细胞膜上还进行酶催化反应和能量转化过程。同时,这样的系统还可以在仿真系统中进行试验性构造。其中 一种方法是创建胶束或生物分子膜,该方法被用来增加不溶物质的溶解性,以及为多种反应提供空间。最近开发的纳米微粒就是它的广泛应用之一。这就给我们带来一个问题,如果在一个较小的尺度上,为单个分子或几个分子的内容物创造一个隔离的腔的特殊环境是可能的,那么,我们所感兴趣的,由主体-客体创造出来的大的空分子和超分子化学将引起关注1。大的空分子,或分子胶囊,是合成的内部封闭的主体分子,为确保它的牢固而精确的分子识别而被设计成三维的。由于其结构复杂,封闭的客体分子存在于从外部隔绝的环境中,因此,和这一特殊环境相对应的物理性质和化学反应都可以被鉴定。这些特征和以上所提到的生物膜的特征是相似的,因此,强调分子胶囊是候补生物膜的最小实验模型并不为过。最近,非共价键的巧妙应用使得分子胶囊的温和合成成为可能,大量关于分子设计和分子功能性的报道开始出现。
基于这些事实,我们实验室的研究一直集中在使用非共价键和半球形化合物合成分子胶囊,以及将所合成的主体-客体复合物作为功能材料进行应用。本文中,我们将焦点集中于基于卟啉和杯芳烃的分子胶囊上,同时还包括近期我们研究所取得的进展。
2. 使用杯芳烃骨架的分子胶囊
自从Gutsche等确立了杯芳烃的一步合成法2,杯芳烃迅速成为备受关注的主体分子,由苯酚单元构成的结构允许它可以像冠醚一样作为优秀的离子载体,并且为多种官能团提供位置,一系列的万能衍生物已见诸报道3。在众多的构象异构体中,杯芳烃(本节所讨论的主要是四聚体构象异构体和氧杂同杯芳烃)是已知的被采用的,其椎体构造被作为一个结构单元优先开发,因为它带有一个半球形的空腔(图 2)4。

本节将介绍自组装杯芳烃胶囊。
2.1 由氢键形成的杯芳烃胶囊
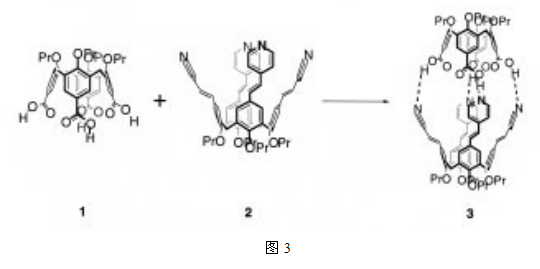
氢键是已知的作为形成DNA双螺旋结构和维持高度有序的蛋白质结构的重要相互作用。同时它在分子识别和合成受体与凝胶基质的功能设计方面也非常必要的。之前我们曾报道过由建立在羧基基团和吡啶之间的氢键作用下的胶囊分子自组装(图3)5,这是对氢键作用力驱动下的杯芳烃形成的首次报道。
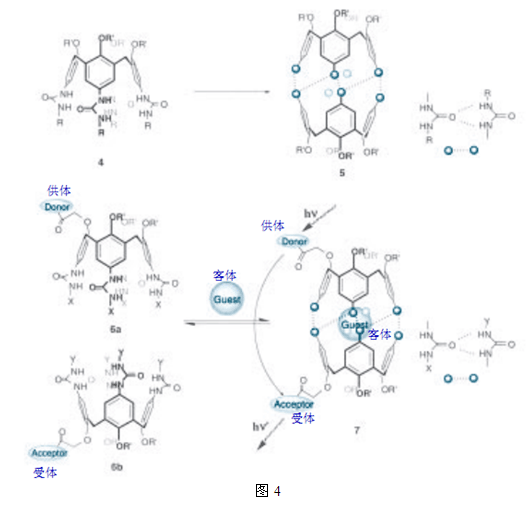
此后,通过氢键形成自组装胶囊被许多研究者所证明6。其中由Rebek 等报道的杯芳烃胶囊引起了极大的关注。他们在杯芳烃上缘引入脲基团,并发现它们之间的互补作用也可以得到胶囊(图4)7。此外,位于脲基团和客体分子上的取代基团(X和Y)之间的协同效应,形成了一个具有杂聚肽结构的胶囊。例如,6a优先和6b形成一个胶囊。基于这些结果,他们报告说,使用一种诸如FRET(荧光共振能量转移技术)的技术,可以将一对具有能量传递能力和电子传递能力的色素(一个作为供体,另一个作为受体)发展成为一个分子传感器8。
2.2 使用配位键形成的杯芳烃胶囊
和氢键一样,配位键也是分子组件形成的一个重要相互作用,近年来,目标胶囊的构造基本上都使用了与钯(II)或铂(II)复合物形成的配位键。Fujita等人以及Stang等人所广泛研究的方法,进行了深入的讨论(参考文献9内的详细内容)。
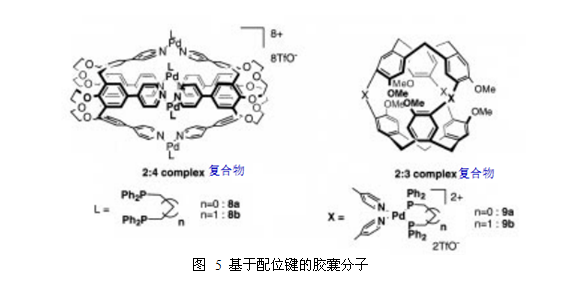
如图5所示,位于钯(II)和铂(II)复合物内的固定顺式结构在胶囊的形成过程中是非常有用的,通过添加适当的分子等效物,可以很容易的得到目标胶囊10。
我们曾报道过将氧杂同杯芳烃10和顺式钯(II)复合物11按2:3的摩尔比相混合时,可以得到具有高度对称性的胶囊分子12(图6)11。
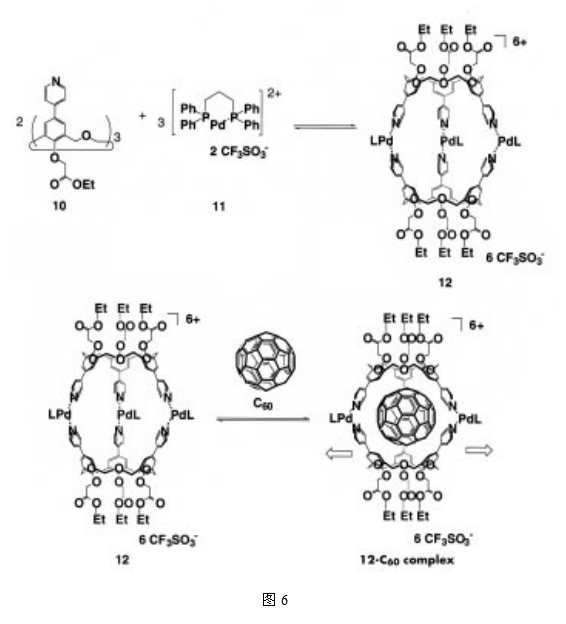
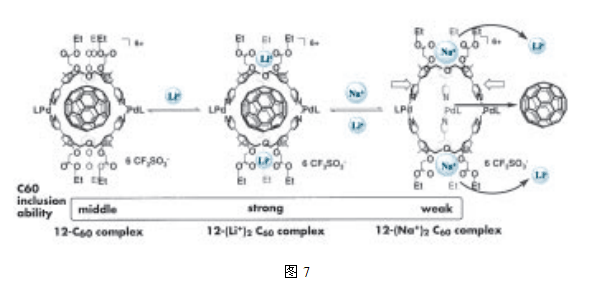
这个大的空分子12能够将C60作为内容物,并且在室温下,复合物状态和非复合物状态之间的转化速率要比核磁共振时间尺度慢12。更为有趣的是,它并不能将更大的客体分子C70封装在内部。鉴于未改性的氧杂同杯芳烃单体具有二维的腔体,而且对C60和C70基本上未显示出选择性(C60/C70=0.99),这就预示着对C60/C70的严格识别起作用的是大的空分子12的三维立体腔。而且锂离子的加入将大的空分子12初步排列成为适合内容C60的构象,在锂离子存在的条件下,实际测量的大的空分子12(Li+)和C60的缔合常数是没有锂离子存在时的50倍,然而,当钠离子被添加到该系统后,由于钠离子比锂离子具有更高的亲和力,胶囊就形成了一个含有钠离子的复合物,所得到的大分子牢笼式络合物12(Na+)从结构性来说是不利的,因此,C60就从腔内被释放出去13。这种立体结构的扭曲要归因于钠离子的半径比锂离子的半径大,这就使得在复合物的形成过程中,胶囊空腔要比C60的尺寸显得更加瘦长。这表明外部刺激,比如碱金属的加入,可以通过改变胶囊的结构,进而控制包裹速率以及C60的释放速率(图7)。
间苯二酚芳烃由间苯二酚骨架构成,是一种类杯芳烃环状寡聚体,也是可以作为分子胶囊构成单元进行开发的化合物之一14。如Dalcanale所报道的,将两个氰基基团引入到间苯二酚四聚体,紧接着和钯(II)或Pt(II)复合物形成配位键也可以形成胶囊分子(图8)14。

这一大的空分子显示了独特的特点。它在胶囊形成过程中引入一个平衡负离子和一个三氟化物分子,同时它只形成同单体胶囊,并且仅表现出少量的构象上的差异16。他们的研究还包括使用AFM(原子力显微镜)在网格上排列胶囊分子的胶囊形成过程(图9)17,如果我们可以像他们的系统所描述的那样构造胶囊分子,那么基于此种独特的内容能力的膜传感器的应用将是可行的。
2.3 胶囊分子包卷[C60]富勒烯
C60是为数不多的优良感光剂之一,它可以满足诸如在可见光频谱内具有广泛的吸收范围、系统间转移的收率基本为100%、高还原势能以及激发三重态和自由基的特征吸收的标准。无论是从有机化学、无机化学还是生物化学的角度来看,这些特点都非常有趣。然而其溶解度低一直阻碍其使用,特别是对其在溶液中的物理性质的研究。
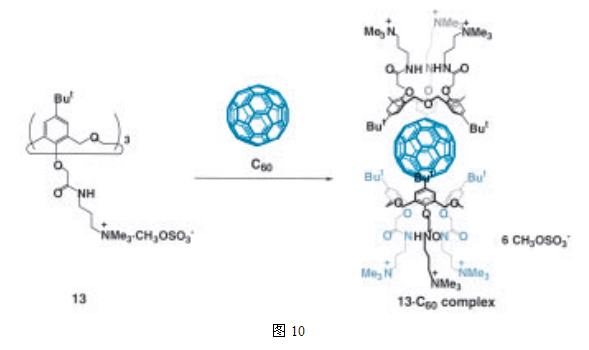
如上面所述,氧杂同杯芳烃分子对C60有较高的亲和力和选择性。通过使用氧杂同杯芳烃的胶囊结构,我们已成功地将C60溶解在水中(图10)18。这种主体-客体复合物是通过对疏水性和π-π相互作用的熟练应用建立起来的,C60既是客体分子,又是胶囊成分,因此,C60分子在溶液中可以不与其他分子发生相互作用而独立起作用,从而允许新功能的出现。
我们已经使用这种复合物获得了有价值的结果。
1) 光诱导DNA断裂
这种大分子牢笼式络合物通过来自于复合物内部的阳离子亲水基团的静电作用力,与DNA分子连在一起,在结合过程中,光照射到C60上,相邻的DNA链发生断裂(图11)19。
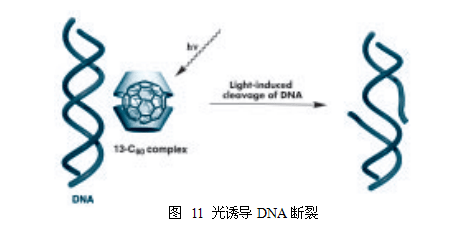
另一方面,已知的由聚乙烯吡咯烷酮(PVP)溶解的C60在光照下对DNA断裂显示出非常低的效率,在断裂速率上的差异被认为要归因于以下事实:1)PVP不与DNA发生相互作用,2)在PVP腔内C60分子间存在相互作用。与此相比,13-C60大分子牢笼式络合物是诱导的DNA破坏的一个极好的化学物质。
2) 在有机光电转换元件上的应用
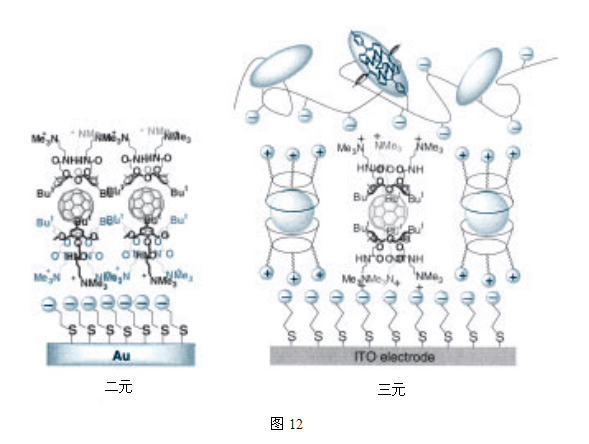
使用交替逐层吸附法可以很容易的将C60内容胶囊开发成为有机光电转换装置,到目前为止,二元和三元有机光电转换元件已被成功的构造出来(图12)20。尤其是在三元系统中,它的光电转换率已达到21%,证明了从C60大分子牢笼式络合物派生出的装置所具有的的效率21。
3. 基于卟啉的自组装大的空分子
鉴于其电化学和光学活性,卟啉也被用来作为电子和能量转移的材料22。最近,基于它可以作为供体22和凝胶基质的构成单元23的能力,它已被应用于富勒烯的识别,其应用范围似乎是无限的。
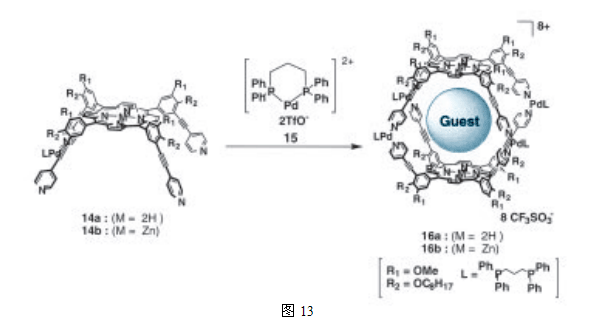
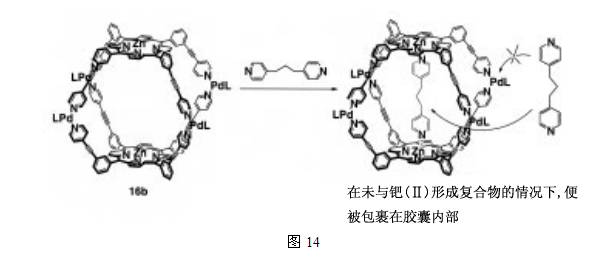
之前Lehn 等人和 Stang等的结果已经表明,当把具有吡啶单元的各种卟啉与具有固定的顺式构型的钯(II)或铂(II),按照适当的比例混合时,卟啉会自组装成二聚体和四聚体复合物25,在此基础上,我们使用钯(II)和吡啶之间的相互作用,设计了一种自组装的卟啉胶囊,图13显示了一个通过建立在钯(II)和吡啶之间的,并位于卟啉分子内的配位键自组装起来的卟啉胶囊26。卟啉16b的腔具有容纳一个具有合适尺度的吡啶客体分子的能力,这个内容物最吸引人的特点在于,客体分子的吡啶并未与钯(II)形成复合物便胶囊化了,换句话说,客体分子在不扰乱胶囊结构的前提下稳定存在于空腔内,这被认为是由于大的空分子具有的的稳定性和高效选择性,以及客体分子的包容能力造成的。
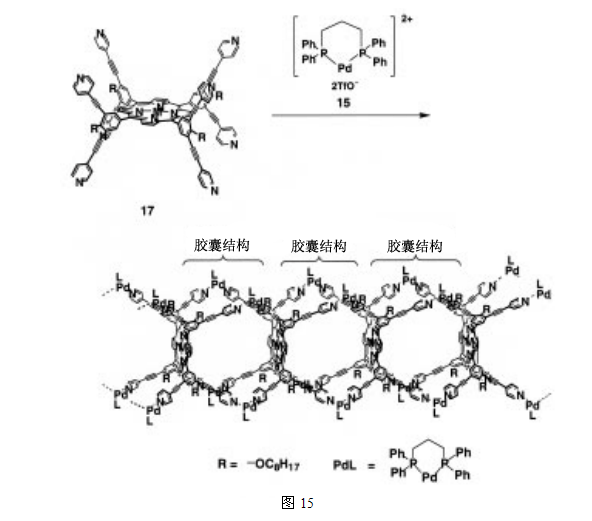
我们还报道了卟啉胶囊的主要路线(聚合)。像上面所提到卟啉胶囊的形成过程,卟啉胶囊自组装成聚合物,如图15所示27。尽管卟啉胶囊呈线性排列,但聚合物的主链需要一个结构,因此,卟啉聚合物保留了它的内容能力。事实上,可以在聚合物腔内捕获一个客体分子1,3-二吡啶基丙烷。
3.1 相连的卟啉杯芳烃的分子胶囊
在大的空分子内有许多基本构建单元,它们的组合有时会产生有价值的结果,尤其是杯芳烃和卟啉组成的杂聚肽胶囊,往往表现出比每个物质本身所起的功能多得多的功能性。
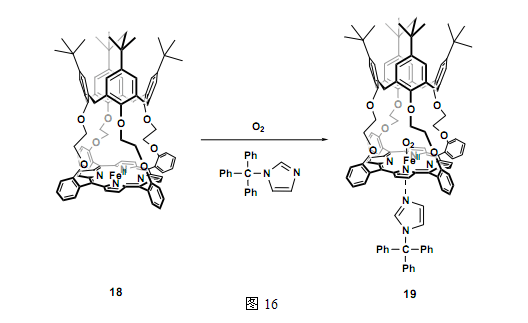
Osa和他的同事合成了以铁(II)-卟啉为上缘的杯芳烃,并报道说这种胶囊可以作为氧载体的模型(图16)28。尽管铁(II)-卟啉本身是能够与氧结合的,但复合物却并不是很稳定,复合物增加了其内容氧时的稳定性。因此,杯芳烃的腔可以改善卟啉的功能。
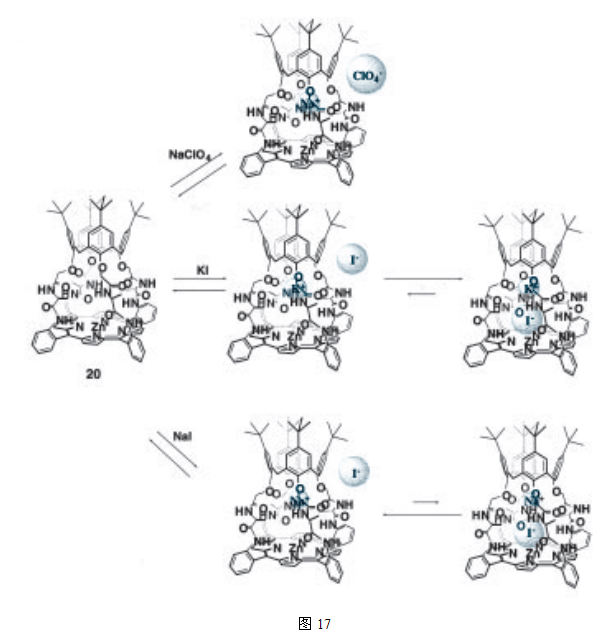
我们已经合成了具有间隔取代基的杯芳烃 - 卟啉胶囊,该取代基对碱金属阳离子具有较高的亲和力,同时还发现,相连接的胶囊表现出特殊的内容行为(图17)29。容器分子20可以通过4组羰基捕获碱金属离子,此外,当添加碘化钠或碘化钾时,平衡负离子I- 也会被胶囊包裹起来,仔细分析可知,I- 是在与碱金属离子之间的静电相互作用下,通过与卟啉中心的锌的协同作用被裹入的。此外,这种独特的内容行为在添加碘化钾(碘化钾具有胶囊20最偏爱的尺寸)时表现的最为明显。这表明,大的空分子20不仅对碱金属离子具有较高的选择性和识别能力,对平衡负离子也是如此。因此,它可以作为一种优良的传感金属来使用,它所展现的是一种在其他离子传感器上未发现的全新的系统。
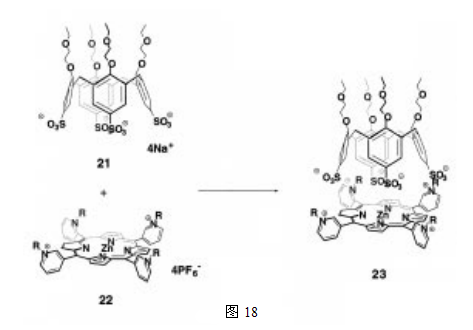
根据以上所介绍的两个系统可知,具有C4对称性的卟啉与杯芳烃的组合体,不论从键的数量上还是取向上来说,都是非常好的。这就使得通过非共价键自组装来构建杂聚肽胶囊成为可能。事实上,Reinhoudt等已经在卟啉中引入了一个阳离子取代基,并且展示了在静电力作用驱动下的杂聚肽胶囊23的自组装(图18)30。
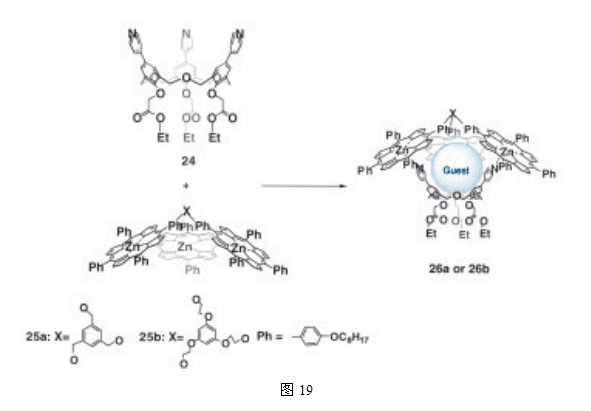
另外,我们发现,具有一个吡啶单元上缘的氧杂同杯芳烃和锌(II)-卟啉三聚体,通过锌离子和吡啶之间的协同作用,形成了杂聚肽胶囊26(图19)31。我们还发现,在它的腔内明显含有受体分子,如C60。
4. 结论
在这篇文章中,我们主要讨论了胶囊分子的具体内容行为和所得到的主客体复合物的应用。在一个全世界的研究者都参与到纳米技术和纳米化学研究的激烈竞争中的年代,具有纳米腔的大的空分子很可能在未来的研究中造成一次大的轰动。我们期待着这一研究在未来研究中的进一步发展。
参考文献
1) Cram, D. J.; Cram, J. M. Container Molecules and Their Guests, Monographs in Supramolecular Chemistry.
2) Gutsche,C. D. Acc. Chem. Res. 1983, 16, 161.
3) Ikeda, A.; Shinkai, S. Chem. Rev. 1997, 97, 1713.
4) Hof, F.; Craig, S. L.; Nuckolls, C.; Rebeck, J., Jr. Angew. Chem. Int. Ed. 2002, 41, 1488.
5) Koh, K.; Araki, K.; Shinkai, S. Tetrahedron Lett. 1994, 44, 8255.
6) a) Arduini, A.; Fabbi, M.; Mantovani, M.; Mirone, L.; Pochini, A.; Secchi, A.; Ungaro, R. J. Org. Chem. 1995, 60,1454. b) Arduini, A.; Domiano, L.; Ogliosi, L.; Pochini, A.; Secchi, A.; Ungaro, R. J. Org. Chem. 1997, 62, 1454. c) Struck, O.; Verboom, W.; Smeets, W. J.; Spek, A. J.; Reinhoudt, D. N. J. Chem. Soc., Perkin Trans. 2 1997,223.
7) a) Shimizu, K. D.; Rebek, J., Jr. Proc. Natl. Acad. Sci. U. S. A. 1995, 92, 12403. b) Hamman, B. C.; Shimizu, K.D.; Rebek, J., Jr. Angew. Chem. Int. Ed. Engl. 1996, 35, 1326. c) Castellano, R. K.; Rudkevich, D. M.; Rebek, J., Jr. Proc. Natl. Acad. Sci. U. S. A. 1997, 94, 7132. d) Castellano, R. K.; Rebek, J., Jr. J. Am. Chem. Soc.1998, 120, 3657. e) Castellano, R. K.; Nuckolls, C.; Eichhorn, S. H.; Wood, M. R.; Lovinger, A. J.; Rebek, J., Jr. Angew. Chem. Int. Ed. Engl. 1999, 38, 2603.
8) Castellano, R. K.; Craig, S. L.; Nuckolls, C.; Rebek, J., Jr. J. Am. Chem. Soc. 2000, 122, 7876.
9) a) Fujita, M. Chem. Soc. Rev. 1998, 27, 417. b) Takeda, N.; Umemoto, K.; Yamaguchi, K.; Fujita, M. Nature 1999, 398, 794. c) Fujita, M.; Nagao, S.; Ogura, K. J. Am. Chem. Soc. 1995, 117, 1649. d) Leininger, S.; Olenyuk, B.; Stang, P. J. Chem. Rev. 2000, 100, 853.
10) a) Zhong, Z. L.; Ikeda, A.; Ayabe, M.; Shinkai, S.; Sakamoto, S.; Yamaguchi, K. J. Org. Chem. 2001, 66, 1002. b) Zhong, Z. L.; Ikeda, A.; Shinkai, S.; Sakamoto, S.; Yamaguchi. K. Org. Lett. 2001, 3, 1085.
11) Ikeda, A.; Yoshimura, M.; Tani, F.; Naruta, Y.; Shinkai, S. Chem. Lett. 1998, 587.
12) Ikeda, A.; Yoshimura, M.; Udzu, H.; Fukuhara, C.; Shinkai, S. J. Am. Chem. Soc. 1999, 121, 4296.
13) Ikeda, A.; Yoshimura, M.; Udzu, H.; Shinkai, S. Tetrahedron 2000, 56, 1825.
14) a) Kobayashi, K.; Shirasaka, T.; Yamaguchi, K.; Sakamoto, S.; Horn, E.; Furukawa, N. Chem. Commun. 2000,41. b) Chapman, R. G.; Sherman, J. C. J. Am. Chem. Soc. 1998, 120, 9818. c) Shivanyuk, A.; Paulus, E. F.; Bohmer, V. Angew. Chem. Int. Ed. 1999, 38, 2906.
15) Jacopozzi, P.; Dalcanale, E. Angew. Chem. Int. Ed. Engl. 1997, 36, 613.
16) Fochi, F.; Jacopozzi, P.; Wegelius, E.; Rissanen, K.; Cozzini, P.; Marastoni, E.; Fisicaro, E.; Manini, P.; Fokkens, R.; Dalcanale, E. J. Am. Chem. Soc. 2001, 123, 7539 (2001).
17) Levi, S. A.; Guatteri, P.; van Veggel, F. C. J. M.; Vancso, G. J.; Dalcanale, E.; Reinhoudt. D. N. Angew. Chem.Int. Ed. 2001, 40, 1892.
18) Islam,S. D. M.; Fujitsuka, M.; Ito, O.; Ikeda, A.; Hatano, T.; Shinkai, S. Chem. Lett. 2000, 78.
19) Ikeda, A.; Hatano, T.; Kawaguchi, M.; Suenaga, H.; Shinkai, S. Chem. Commun. 1999, 1403.
20) Hatano, T.; Ikeda, A.; Akiyama, T.; Yamada, S.; Sano, M.; Kanekiyo, Y.; Shinkai, S. J. Chem. Soc., PerkinTrans. 2 2000, 909.
21) Ikeda, A.; Hatano, T.; Shinkai, S.; Akiyama, T.; Yamada, S. J. Am. Chem. Soc. 2001, 123, 4855.
22) a) Uosaki, K.; Kondo, T.; Zhang, X. Q.; Yanagida, M. J. Am. Chem. Soc. 1997, 119, 8367. b) Imahori, H.; Yamada, H.; Ozawa, S.; Ushida, K.; Sakata, Y. Chem. Commun. 1999, 1165. c) Imahori, H.; Yamada, H.; Nishimura, Y.; Yamazaki, I.; Sakata, Y. J. Phys. Chem. B 2000, 104, 2099. d) Nomoto, A.; Kobuke, Y. Chem. Commun. 2002, 1105.
23) a) Tashiro, K.; Aida, T.; Zheng, J.-Y.; Kinbara, K.; Saigo, K.; Sakamoto, S.; Yamaguchi, K. J. Am. Chem. Soc.1999, 121, 9477. b) Nishioka, T.; Tashiro, K.; Aida, T.; Zheng, J.-Y.; Kinbara, K.; Saigo, K.; Sakamoto, S.; Yamaguchi, K. Macromolecules 2000, 33, 9182. c) Ayabe, M.; Ikeda, A.; Kubo, Y.; Takeuchi, M.; Shinkai, S. Angew. Chem. Int. Ed. 2002, 41, 2790. d) Ayabe, M.; Ikeda, A.; Shinkai, S.; Sakamoto, S.; Yamaguchi, K. Chem. Commun. 2002, 1032.
24) a) Tamaru, S.; Nakamura, M.; Takeuchi, M.; Shinkai, S. Org. Lett. 2001, 3, 3631. b) Tamaru, S.; Uchino, S.; Takeuchi, M.; Ikeda, M.; Hatano, T.; Shinkai, S. Tetrahedron Lett. 2002, 43, 3751.
25) a) Drain, C. M.; Lehn, J. M. J. Chem. Soc., Chem. Commun. 1994, 2313. b) Stang, P. J.; Fan, J.; Olenyuk, B.; Chem. Commun. 1997, 1453. c) Fan, J.; Whiteford, J. A.; Olenyuk, B.; Levin, M. D.; Stang, P. J.; Fleischer, E. B. J. Am. Chem. Soc. 1999, 121, 2741.
26) Ikeda, A.; Ayabe, M.; Shinkai, S.; Sakamoto, S.; Yamaguchi, K. Org. Lett. 2000, 2, 3707.
27) Ikeda, A.; Ayabe, M.; Shinkai, S. Chem. Lett. 2001, 1138.
28) Kobayashi, N.; Mizuno, K.; Osa, T. Inorg. Chim. Acta 1994, 1, 224.
29) Nagasaki, T.; Fujishima, H.; Takeuchi, M.; Shinkai, S. J. Chem. Soc., Perkin Trans. 1 1995, 1883.
30) R. Fiammengo, P. Timmerman, F. De Jong, D. N. Reinhoudt, Chem. Commun., 2000, 2313.
31) Ikeda, A.; Sonoda, K.; Shinkai, S. Chem. Lett. 2000, 1220.
注:本文为提供者翻译的,由于知识所限,其中错误在所难免,敬请原谅。如有问题可以查找原文。



 沪公网安备 31010602001115号
沪公网安备 31010602001115号